我的博文
综述:先天性巨结肠的诊断
【前言】
首先,非常感谢湖南省儿童医院病理科主任陈卫坚老师的讲课:《直肠粘膜活检乙酰胆碱酯酶(AChE)检测--病例分享与短期经验总结》。先天性巨结肠(Hirschsprung disease,HSCR)的诊断在大多数儿童医院都是一项经常性的工作。虽然HSCR可能出现在不同的年龄并具有不同的临床表现,但最常见的表现是新生儿严重便秘或肠梗阻。包括灌肠和肛门直肠测压在内的各种诊断试验可作为诊断筛查,但最终诊断取决于直肠黏膜活检的组织病理学评估。对于有经验的病理学家来说,常规HE染色切片通常足以排除HSCR或确定诊断。Ambartsumyan等于2019年在《Pediatric and Developmental Pathology》杂志发表了题为《Diagnosis of Hirschsprung Disease》的文章,回顾了HSCR的临床和病理学特征,讨论了如何解决工作中特别具有挑战性的诊断问题。本文将其主要知识点翻译如下:
【流行病学和临床表现】
先天性巨结肠(HSCR)是一种复杂的多基因疾病,其特征是肠道黏膜下和肌间神经丛中缺乏固有神经节细胞。无神经节段从远端的肛门内括约肌(internal anal sphincter,IAS)开始,并向近端延伸,受累肠段长度不一。约80%患者的无神经节细胞段仅限于直肠乙状结肠(短段HSCR),3%~10%患者整个结肠无神经节细胞,称为全结肠无神经节细胞症(total colonic aganglionosis,TCA),少数患者无神经节细胞延伸到近端小肠。超短段HSCR(Very short-segment HSCR,vssHSCR)是指直肠远端≤2cm的无神经节细胞段。尽管在诊断和治疗方面取得了进展,但报告的死亡率为2%~5%。HSCR患儿的生活质量明显降低,对他们的社会和情感健康产生负面影响,体力活动减少。随着年龄增长,患儿出现的症状如大便失禁或便秘让患儿和家属都感到焦虑和抑郁。
全球范围内的HSCR发病率从1:5000到1:10000不等,并且在不同的种族群体中有所不同。在短段HSCR中,男女比例为3:1~4:1。在长段HSCR中,男女比例为1:2~2:1。
对于伴有相关畸形的儿童,HSCR的怀疑指数应增加。非综合征或孤立的HSCR占儿童患者的70%,但大约30%的HSCR儿童具有相关染色体(12%)和/或先天性(18%)异常。21三体综合征(唐氏综合征,DS)是最常见的染色体异常。DS患者发生HSCR的风险比非DS者高50~100倍。与非HSCR患者相比,HSCR患者增加发生炎症性肠病(inflammatory bowel disease,IBD)的风险【参考文献:Increased Risk of Inflammatory Bowel Disease in a Population-based Cohort Study of Patients With Hirschsprung Disease.JPGN,2018, 66(3):398-401.】。与HSCR常相关的综合征包括Waardenburg-Shah综合征、Goldberg-Shprintzen综合征、多发性内分泌肿瘤2A、先天性中枢性低通气综合征和Mowat-Wilson综合征等。相关的先天性异常可能包括心脏、胃肠道、泌尿生殖系统、四肢、中枢神经和周围神经系统的畸形。综合征性HSCR和非综合征性HSCR,以及其他器官系统中常见的相关异常,都与导致肠神经系统发育的多个基因的致病性变异有关。
HSCR的遗传学异常复杂,涉及多个易感位点。HSCR易感性的遗传学观点认为,HSCR易感性主要来源于多种罕见和常见的基因变异,这些基因大多通过RET受体酪氨酸激酶损害信号转导。大多数非综合征患者和一部分综合征患者的HSCR易感性可通过以下一个或多个基因位点上常见的低外显率非编码变异的组合效应来解释:RET、NRG1和SEMA3。相比之下,在综合征性HSCR中,常出现主要的染色体改变(如21三体)或罕见的12个基因(RET、GDNF、NRTN、SOX10、EDNRB、EDN3、ECE1、ZFHX1B、PHOX2B、KBP、TCF4和L1CAM)高外显率突变。这些复杂的遗传学异常可能导致临床结果的差异。
尽管HSCR在历史上被认为是新生儿期的一种疾病,但一项对全国住院患者数据的回顾性调查显示,只有6.5%的患者在出生后的第一周内出现,平均和中位出现年龄分别为3岁和1岁。6个月内发生率为40%,1岁内发生率为50%,2岁、7岁和13岁内发生率分别为60%、80%和93%。临床症状因年龄和无神经节段的范围而不同。新生儿通常表现为胎粪排出延迟(>48h)、喂养不耐受、腹胀和胆汁呕吐,这些症状与肠梗阻有关。盲肠、升结肠或阑尾穿孔可能是高达5%的新生儿HSCR的主要症状。有较长节段无神经节细胞增多症的儿童,如TCA,通常发生于有肠梗阻症状的新生儿;然而,高达14%的大于6个月的患儿延迟出现症状。新生儿期过后,婴幼儿可能会出现长期存在的轻度至重度便秘,对口服泻药不敏感(refractory to oral laxatives),依赖直肠治疗(dependent on rectal therapies),并伴有呕吐、腹胀和生长迟缓(vomiting, abdominal distention, and growth failure)。其病程可并发急性肠梗阻、反复便秘(recurrent fecal impactions)、急性危及生命或慢性小肠结肠炎。先天性巨结肠相关性小肠结肠炎(Hirschsprung-associated enterocolitis,HAEC)的特征是爆发性腹泻(常为血性)、发热和腹胀。术前和术后分别有6%~60%和25%~37%的患者出现HAEC,报告死亡率为1%~10%。
儿童以后,尤其是成年后的HSCR是比较少见的。Doodnath和Puri在对成人HSCR的系统回顾和荟萃分析中报告,79.8%和12.5%的患者仅局限于直肠和乙状结肠。大多数在新生儿期出现症状,随后终生便秘,腹胀,疼痛,对泻药或灌肠反应不良。因此,儿童期有难治性便秘的青少年或成人都因怀疑有HSCR的可能。
【诊断程序】
对高度怀疑为HSCR的患者应进行系统的诊断评价。HSCR诊断检查有两种筛查方法:对比灌肠法(contrast enema,CE)和肛管直肠测压法(anorectal manometry,ARM)。有HSCR相关表现的患者建议进行直肠抽吸活检(rectal suction biopsy,RSB)。如果RSB的结果不明确,建议进行全层活检(fullthickness biopsy,FTB)以确定诊断。对于大龄患者(如1岁以上的患者),一些中心在开始时就提倡FTB而不是RSB。
(1)对比灌肠
CE是一种广泛应用筛查HSCR的方法。和ARM一样,它的侵袭性比直肠黏膜活检要小,与ARM不同的是,它需要有经验的放射科医生来操作和准确解释这个结果。在造影过程中,水溶性造影剂通过放置在肛门内的导管注入结肠,然后进行实时荧光成像。
提示HSCR的结果包括影像学上存在移行区(transition zone,TZ)、近端扩张的肠管(proximal dilated bowel)、结肠变小(microcolon)、排空后造影剂的保留(retention of contrast on postevacuation film)、不规则结肠收缩(irregular colonic contractions)、粘膜不规则(mucosal irregularity)和直肠乙状结肠比率异常(abnormal rectosigmoid ratio)。直肠乙状结肠比率通常大于1,小于1时提示为HSCR。影像学上移行区的位置与无神经节段,特别是和直肠乙状结肠段的长度有关,可能有助于外科手术的规划。然而,在直肠乙状结肠近端段和小于3个月龄的儿童之间的相关性较低(However, correlation was lower in segments proximal to the rectosigmoid and in children younger than 3 months of age.)。Muller等人报道的79例HSCR患者中,TZ和神经节细胞缺乏的长度的总体一致性为58.1%(κ=0.39)。这进一步强调了术中活检对指导手术计划的重要性。在长段型HSCR患者,特别是全结肠无神经节细胞症(total colonic aganglionosis,TCA)患者中,可能出现错误或不准确的TZ报告,从而导致诊断和治疗延迟。此外,对于超短段HSCR(Very short-segment HSCR,vssHSCR)儿童,TZ可能不明显。使用灌肠、灌洗或直肠检查在结肠造影前对远端结肠减压,并在导管上充气以注入造影剂,可扭曲vssHSCR患者的TZ,导致结果不准确。
文献中报道的CE诊断准确率不一。de Lorijn等人报道,与ARM和RSB相比,CE的平均敏感性和特异性分别低于70%和83%。此外,新生儿期的CE比大龄儿童更不可靠。新生儿患者CE结果假阴性的概率是大龄儿童的7倍。因此对于一个怀疑是HSCR的患者,即使CE是正常也不能排除HSCR,建议直肠黏膜活检。
(2)肛管直肠测压
肛管直肠测压法(anorectal manometry,ARM)用于评估肛门直肠的随意性和非随意性(ARM is used to evaluate the voluntary and the involuntary properties of the anorectum)。这是儿童最常见的运动测试,不需要太多的准备,只要术前清洁肠道,不合作的患儿使用镇静剂。镇静药物的选择是至关重要的,因为它可能影响直肠肛管抑制反射(rectoanal inhibitory reflex,RAIR)或降低肛内压,导致RAIR的评估困难。与直肠黏膜活检相比,它的侵袭性小,而且与CE不同,它不暴露于辐射中。ARM的操作和结果解释需要操作员有相关技能和知识。北美儿科胃肠病、肝病和营养学会推荐在具有测压能力的中心,ARM应作为HSCR的初步筛查手段。在作者工作的医院,该方法用于3个月以上婴儿的HSCR筛查。
如果ARM的结果与HSCR一致或模棱两可,则将患者转诊去做直肠黏膜活检。de Lorijn等人比较了ARM、CE和RSB对疑似HSCR的婴儿的诊断准确性。他们报告RSB是最准确的检测方法,最高的平均灵敏度为93%,平均特异性为98%。ARM的诊断准确率稍低,平均敏感性91%,特异性94%。然而,ARM与RSB的诊断准确率差异很大,在一些研究中,ARM的特异性和阳性预测值显著降低。此外,文献报道ARM在新生儿HSCR诊断中的准确性不一。在对小于6个月的婴儿进行ARM诊断准确性的亚组分析中,de Lorijn等人发现总的敏感性为88%,特异性为89%,但与总组相比没有显著差异。同样,Meinds等人在他们研究中也没有显示出3个年龄组之间的显著差异。
ARM的假阴性结果可归因于导管移位或肛门外括约肌松弛。假阳性结果可归因于空气泄漏、导管和设备问题以及气球充气不足。2008年推出的高分辨率ARM解决了传统导管的局限性。有越来越多的传感器以沿周向和纵向轴线的紧密间隔放置,从而提高了研究的分辨率,从而使研究更容易进行和更有效。ARM被认为是HSCR的筛选试验,阳性结果应经RSB证实。
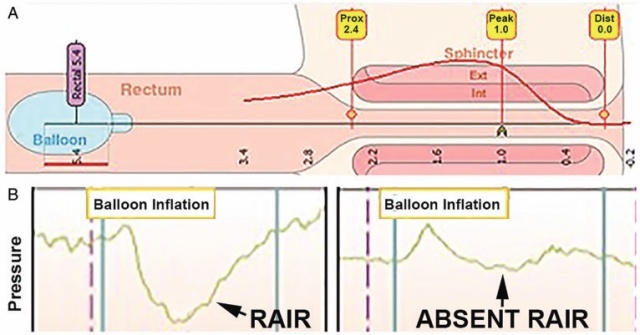
图1: 肛管直肠测压图(A),显示直肠气囊和肛管传感器的位置(黄色正方形)(数字是距肛缘的距离,单位为厘米)。典型的单传感器压力描记(B),分别来自正常RAIR(左)和无RAIR(右)的患者。
(3)直肠抽吸活检
1948年,Whitehouse和Kernohan发表了第一篇详细的病例报道,确定了HSCR的主要表型特征是直肠远端神经节细胞缺乏(aganglionosis)和受累肠管长度不一。从那时候起,HSCR的确诊或排除取决于直肠黏膜活检的组织学评价。最初是在麻醉下进行切口活检(incisional biopsies),直接观察肛管和直肠远端情况。切口活检可有大量组织样本,通常足够深,包括固有肌层(smooth muscle layers of the muscularis propria)和肌间神经丛(intervening myenteric plexus)。后来,直肠抽吸活检(rectal suction biopsy,RSB)作为一种新的诊断方法被引入,这种方法可以在不使用全身麻醉的情况下进行,并且不太可能出现明显的出血或感染。尽管有时提倡切口或镊子活检(forceps biopsies),特别是对大龄患者,但RSB已成为大多数患者的首选方法。
有证据表明,婴儿的年龄影响了在RSB中获得足够或诊断组织样本的成功。Meinds等人对1975年至2011年期间接受RSB组织检查的441名患者进行了一次回顾。小于39天的患者平均敏感性只有50%,而大龄患者的敏感性则为88%。诊断特异性高(95%),与年龄无关。这并不是我们的经验,也不是其他研究者的公开经验。在我们单位,RSB是获得组织以排除大多数6个月以下HSCR患者的最初和主要方法。对于12个月以上的患者,我们通常是在手术室进行全层直肠黏膜活检。6~12个月的患者在没有镇静剂的情况下可能不太配合,应该根据具体情况进行评估。
Dobbins和Bill于1965年首次描述了直肠抽吸活检技术。这项技术需要一个专门的直肠活检仪器(图2),它的形状像一把窄筒手枪,枪管侧面有一个孔。正确的取材部位是保证HD诊断的前提。由于接近齿状线处1cm以内肠壁组织内节细胞稀少,取材部位以齿状线2~3cm为最佳。如条件允许,可间隔1~2cm多个部位取材以提高诊断率。不同部位的标本因分别标记。如需要做乙酰胆碱酯酶(AchE)染色,则无需用福尔马林固定,用无任何液体的密闭容器装好或用盐水纱布包好立刻送往病理科。在冰冻切片前将组织上的水分吸干。为满足诊断要求,满意的标本直径不应小于3mm,其中黏膜下组织的含量不宜少于1/3(图3)。
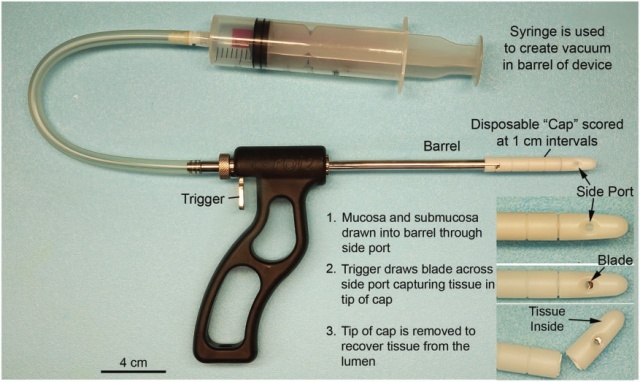
图2:直肠抽吸活检装置
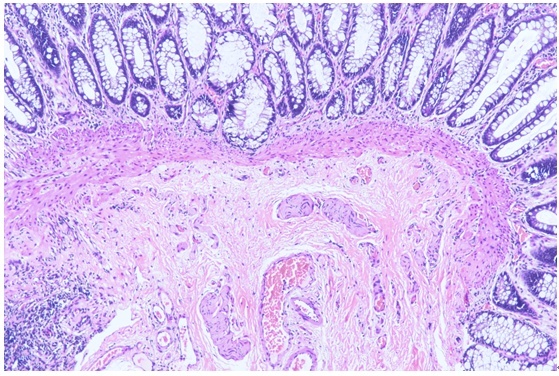
图3:非常满意的直肠黏膜活检标本,黏膜下未见神经节细胞,神经纤维明显增粗。
【病理诊断】
诊断HSCR的外科病理学方法与活检技术同步发展。虽然用于诊断HSCR的方法很多,目前常用的是在HE染色基础上用免疫组化方法检测钙视网膜蛋白(Calretinin,CR)等标记物和酶组织化学染色检测乙酰胆碱酯酶(AchE)。在病理诊断之前,我们先了解一下正常肛肠解剖学。
【1】正常肛肠解剖(Normal Anorectal Anatomy)
为了解释直肠黏膜活检结果,了解正常的肛门直肠解剖是非常重要的。不幸的是,由于肛肠管内标志物的定义和命名不一致,这一问题变得复杂起来。Claus Fenger对这个主题写了一篇很好的评论,他的结论是这里使用的解剖学术语的基础(图4)。
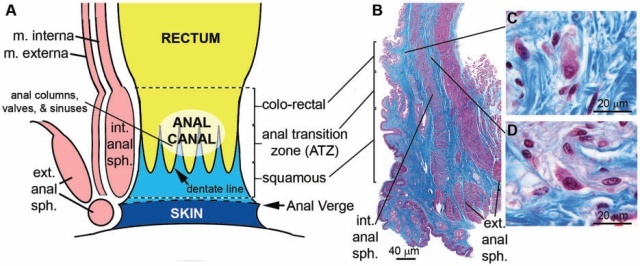
图4:A,肛门直肠解剖图示以说明包括肛管在内的关键标志物,肛管延伸肛门内括约肌的长度,上部被覆结肠黏膜,下端被覆鳞状上皮,中间为肛门过度区/移行区黏膜上皮。B,通过肛管的纵向组织学切片(三色染色)显示黏膜下(C)和肌间(D)神经节细胞。
缩写词:ext.:外部(external); int.:内部(internal);m.:肌层(muscularis);sph.:括约肌(sphincter);
多项研究表明,神经节细胞的密度在正常直肠下端减少。这些现象导致了生理性低位直肠区或者可能是无神经节细胞症的概念,并且建议在该区域附近活检排除HSCR。Aldridge 和Campbell建议至少在肛门瓣膜上方2厘米处[齿状线];其他的明确规定在皮肤黏膜交界处/肛缘>2厘米以上处。这些建议的目的是防止超短无神经节细胞肠段出现假阴性诊断结果。Aldridge 和Campbell检查了20名患者尸体的肛门直肠标本,患者年龄从早产儿到15岁。对于每一个标本,经直肠远端和肛管手术的9个纵切面和9个横向半周断面(齿状线近端的0.5、1.5和2.5厘米,每个位置切3片)进行显微镜检查。这些切片厚5mm,HE染色。尽管在一些标本的3个纵切面上,在肛瓣底部(齿状线)和黏膜下神经节细胞之间发现了长达17mm的间隙,但在一些相应的横切面上,神经节细胞出现在距齿状线<5mm的位置。对2例标本进行连续切片H&E染色,定量分析4 mm长×10 mm厚的浅表黏膜下神经节细胞。同样,在齿状线以上0.5cm处,浅表神经节细胞存在但稀疏。根据这些和其他观察结果,Aldridge 和Campbell得出如下结论:①瓣膜上方0.5厘米处的末端(是齿状线,而不是肛缘)应被视为“神经节细胞稀疏区”(hypoganglionic)而不是无神经节细胞区(aganglionic);②一些病例中,神经节细胞稀疏区被覆过渡(“中间”)上皮[transitional (‘intermediate’) epithelium];③如果在黏膜下神经丛中发现神经节细胞,在肌间神经丛中也会有神经节细胞。
如上所述,大多数外科医生是在距肛缘至少2厘米以上处进行黏膜活检。选择标志物是至关重要的,因为当进行抽吸活检时,齿状线的位置是估计的,但看不到,而且根据患者的年龄,齿状线可能位于肛缘(皮肤黏膜交界处)上方1~9毫米处。在新生儿中,靠近齿状线2厘米的活检很可能在直肠黏膜中,并且可能在超短段型HSCR患者的过度区/移行区(transitional zone,TZ)中,而高于肛缘2厘米的活检可能接近肛管顶部,并且可能在肛门移行区。此外,由于过度区/移行区上皮(transitional epithelium)与大肠黏膜的界面不规则,不同个体之间的管内不同区域的长度差异很大。在多个层面(如肛门边缘近端2、3、4cm)进行抽吸活检的一个原因是减少所有活检组织检查要么过低(transitional mucosa)或太高的可能性。
【2】直肠抽吸活检(Suction Rectal Biopsy)
经直肠抽吸活检确诊或排除HSCR取决于以下因素:①明确的神经节细胞的鉴定(图5):
对于有经验的病理医生来说,在HE染色切片中识别神经节细胞并不困难,特别是在切片质量良好的情况下。典型的细胞学特征包括丰富的细胞质、偏心的圆形细胞核、明显的核仁、核周苍白和染色质位于外周。细胞学上未成熟的神经节细胞,细胞质少,核染色质斑点,核仁不明显,对于初学者来说可能是一个诊断挑战,特别是非常小的婴儿和早产儿。使用免疫组化可能是有帮助的。如果发现有神经节细胞,HSCR通常被排除,除非识别出是移行区(transitional zone,TZ),在这种情况下必须考虑超短段型HSCR。在极少数情况下,巨细胞病毒(CMV)感染可在非神经元细胞中产生,类似于成熟神经节细胞的细胞学改变(图6A)。通常存在一个大的或小的嗜酸性胞质病毒包涵体,这将CMV细胞病理学与神经元分化区分开来。无论是针对神经元特异性抗原(如Hu C/D,Phox2B)还是CMV特异性抗原(图6B)的免疫组化,都可以解决这个问题。更常见的情况是,仔细观察所有的组织切片,将确定明确的CMV细胞学形态,并允许两种诊断,HSCR和活动性CMV感染。
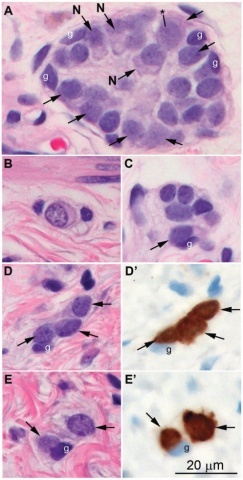
图5 神经节细胞:A至E,黏膜下神经节的典型H&E表现,显示不同分化程度的细胞学形态。许多明确的神经元(箭头)显示,细胞核圆形,染色质细颗粒。部分神经节细胞(N)可见胞浆,胞核偏位,Nissl体±明显核仁(A中星号)。相比之下,肠胶质细胞(g)染色质更浓缩,细胞核卵圆形,胞质边界不易识别。D和E所示的神经节用神经元细胞体特异性标记物anti-Hu进行免疫标记,该标记物突出了神经元(D'和E')。
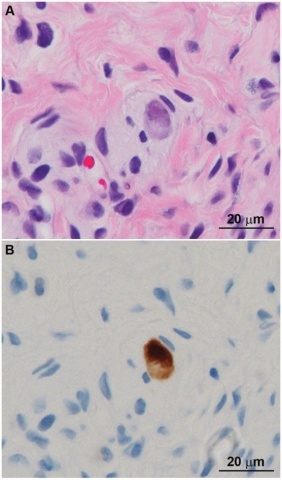
图6:在一例无神经节细胞的HSCR患者中,巨细胞病毒的细胞形态学类似于一个成熟的神经节细胞,黏膜下神经非典型细胞的H&E表现(A),巨细胞病毒特异性抗体阳性表达(B)。
②黏膜活检位置是否适当,如前所述,由于接近齿状线处1cm以内肠壁组织内节细胞稀少,取材部位以齿状线2~3cm为最佳。如条件允许,可间隔1~2cm多个部位取材以提高诊断率。③足够的黏膜下层:完全排除神经节细胞通常需要最大直径为2~3mm的抽吸活检和≥50%的黏膜下层(HE染色切片中,黏膜下组织的含量不宜少于1/3)。如果在没有免疫组化和酶组织化学染色的情况下,至少应有50~75个常规HE染色切面。如果没有发现神经节细胞,并且存在明显的黏膜下肥大神经丛,则可以确定诊断,无需进一步评估。不幸的是,一些活检缺乏这些明确的诊断结果,或具有非典型特征,需要进一步研究。
④黏膜下肥大神经丛:HSCR患者直肠黏膜下无神经节细胞,通常有许多肥大神经丛(图7)。1岁以下婴儿直肠中很少出现直径大于40微米的神经丛,但在老年患者的直肠中常见。在大多数患者中,显著的肥大神经丛(直径>40 微米)是一种可靠的诊断结果,但在一些全结肠无神经节细胞症(total colonic aganglionosis,TCA)患者中可能不存在。
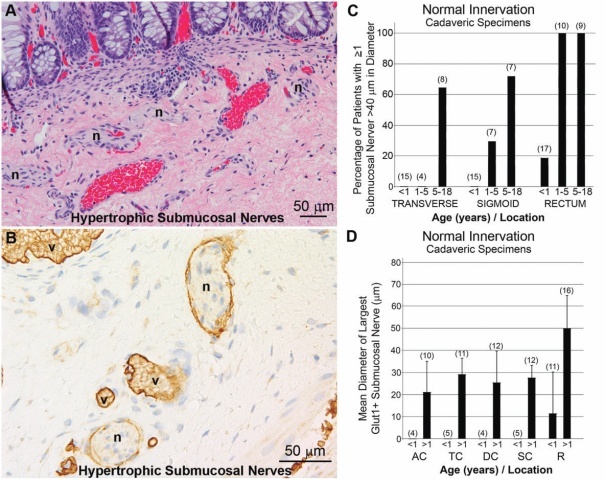
图7:A,黏膜下增生肥大的神经丛(n)几乎总是存在于HSCR患者直肠中。B,这些大神经(n)周围表达Glut1,很容易与邻近血管中Glut1阳性红细胞(v)区分开来。C,1岁以下婴儿直肠中很少出现直径大于40微米的神经丛,但在老年患者的直肠中常见。D,同样地,Glut1阳性神经丛出现在直肠远端时,在婴儿中较少(未显示)且较小。括号中为病例数。
缩写词:AC,升结肠;DC,降结肠;R,直肠;SC,乙状结肠;TC,横结肠。
⑤辅助技术的应用:有经验的病理医生基于HE诊断/排除HSCR是相当可靠的,特别是在多个抽吸活检的多个切片中有足够的黏膜下层时。然而,当活检标本切片只有少量黏膜下或无神经节细胞但未见黏膜下肥大神经丛时,有必要应用(免疫)组织化学来帮助诊断。最广泛应用的辅助方法是AChE组织化学染色(图8)和免疫组化检测calretinin(图9-10)。对于新生儿的直肠黏膜活检,图11(来源文献:钙视网膜蛋白和乙酰胆碱酯酶在新生儿先天性巨结肠症直肠黏膜活检病理诊断中的应用)总结了诊断或排除HSCR的病理诊断流程。大龄儿童也可参考此流程。
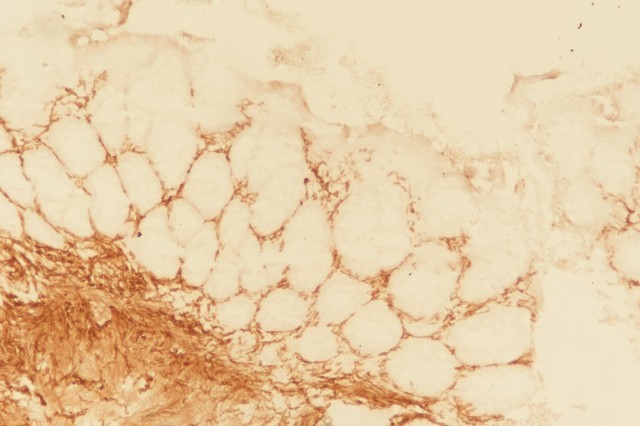
图8:HSCR中AChE染色阳性,可见呈网格状的棕黄色神经纤维。
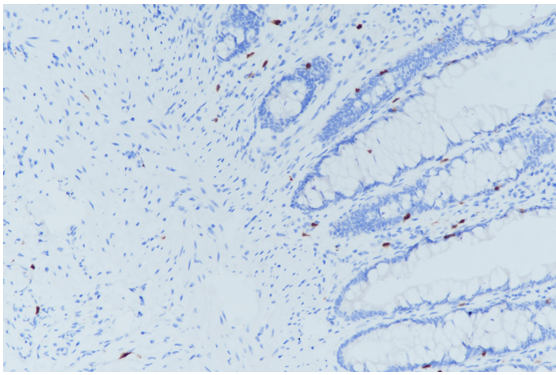
图9:HSCR中calretinin染色阴性,内对照肥大细胞阳性。
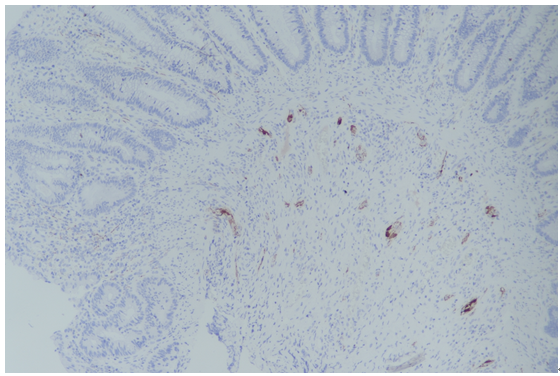
图10:非HSCR中calretinin染色阳性。
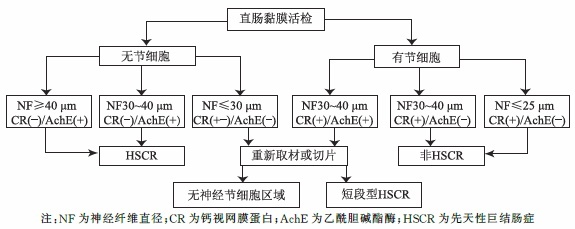
图11:新生儿直肠黏膜活检病理诊断流程图。
【3】直肠黏膜活检报告
直肠黏膜活检的外科病理报告至少应包括每次活检的位置和类型,是否发现神经节细胞或黏膜下肥大神经丛,以及任何辅助染色的结果。报告中诊断行的建议格式示例如下:
直肠黏膜,“距肛缘2厘米”,抽吸活检:
. 神经节细胞存在
. 无黏膜下肥大神经丛
. calretinin染色阳性
直肠黏膜,“距肛缘2厘米”,抽吸活检:与HSCR结果一致
. 未见神经节细胞
. 黏膜下可见丰富的肥大神经丛
. calretinin染色阴性
【4】常见的具有挑战性情况
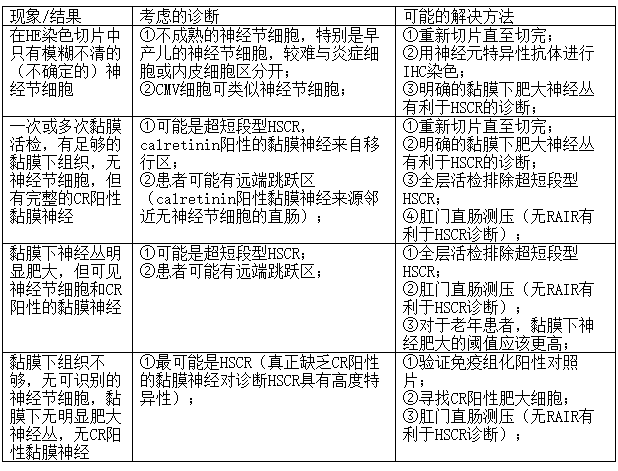
基于直肠黏膜活检的HSCR诊断或排除诊断通常很简单。典型的病理表现包括神经节细胞缺失、黏膜下丰富肥大神经丛、calretinin染色阴性,以及异常丰富、粗大的胆碱能黏膜神经,如AChE组织化学染色所示。然而,在极少数情况下,可能出现难以解释或不一致的现象/结果,这可能是HSCR或相关的异常变化。如表1所示,这些“困难”病例可从其他办法中得到解决。
表1:直肠黏膜活检与HSCR诊断不明确或不一致的情况
~~~End~~~
我要评论






共0条评论