我的博文
小B细胞非霍奇金淋巴瘤——慢性淋巴细胞白血病(2)
CLL/SLL是一种疾病的不同阶段或不同表现,而细胞形态和免疫学特点均相同。需要注意的是有些免疫学和遗传学指标具有判断预后的价值,这可能是临床医生更为感兴趣的地方。
一、免疫表型
1、B细胞标记:CLL瘤细胞当然表达B细胞标记,但表达强度上别具特色:通常CD20,CD22,CD79a呈弱表达,不过个人经验这是流式细胞检测结果,免疫组化一般不太明显,到是遇到过CD20阴性的病例;流式细胞检测常用的CD20相关抗原FMC7通常为阴性或弱表达;CD19呈中等表达。
2、CD5和CD43:经典型CLL可异常表达T细胞标记CD5(图1)和CD43。所以小B细胞类中CD5阳性的淋巴瘤有两种—MCL和CLL。注意图1中的着色模式,深浅不一,大多数细胞呈弱阳性,是CLL的肿瘤细胞,而深染的细胞为残存的正常T细胞。
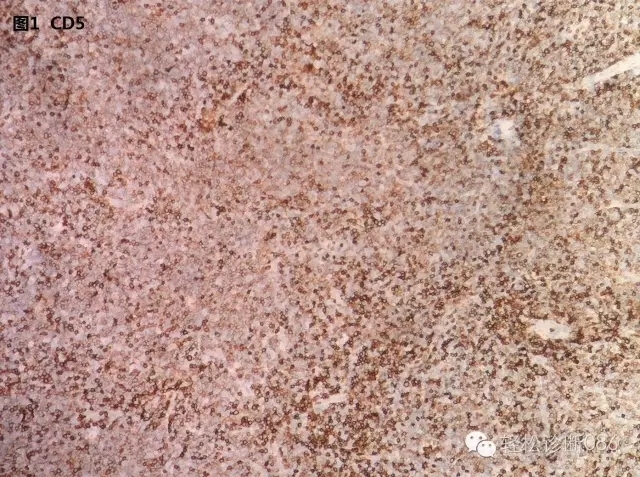
特别需要强调:CD5/CD43组化结果的判读要慎重,特别是对于富含较多T细胞的病例,一定要与CD3的染色相结合,而不是简单地就单一切片来判断阳性还是阴性,否则就会把富含T细胞背景的CD5/CD43染色误判为肿瘤细胞阳性,从而导致错误的诊断。
3、CD23:典型CLL还表达FDCs的标记CD23(图2)。

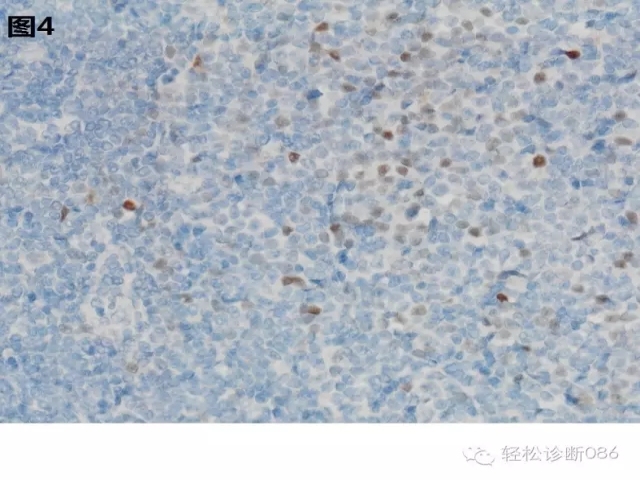
4、CyclinD1:瘤细胞CyclinD1呈阴性,这是与MCL鉴别的重要标记,但CLL增殖中心的细胞cyclinD1可呈阳性(图3-4)。

5、CD10/BCL6:目前认为CLL起源于生发中心后的细胞,所以生发中心标记CD10/BCL6呈阴性。
二、遗传学及其他相关检查
1、遗传易感性:CLL是最常见的家族性白血病,所有血液系统肿瘤中,CLL遗传倾向性最高,故CLL患者的遗传学检测非常重要。
2、抗原受体基因:资料显示CLL依据免疫球蛋白重链基因可变区(IGH@V)重排状态可分为两型:40%~50%的病例为非突变型,这与幼稚的B细胞一致,预后较差;而50%~60%的病例为突变型,预后较好。但不同文献中这两型CLL所占比例有所不同。
3、细胞遗传学和癌基因:用免疫荧光原位杂交(FISH)可以检查出约80%的CLL患者存在异常核型,但与FL和MCL的特征性遗传学诊断标记(忘记的朋友可以再复习一下以前讲过的相关内容哦)不同,CLL的细胞遗传学特征主要作用是其预后价值,用于CLL患者的风险分层和疗效预测。
(1)13q14基因缺失:最常见的CLL基因异常,占CLL异常核型的50%,而且这组患者的预后好于正常核型组及其他遗传学异常组。
(2)12号染色体三倍体:可见于20%的病例,常见于不典型CLL病例,但其预后价值有限。
(3)11q22-23缺失:见于近20%遗传学异常病例,常与疾病进展和明显的淋巴结肿大有关。
(4)17p13缺失:较为罕见,占5-10%,是一个独立的不良预后指标。
三、CLL预后判断
流式细胞检测ZAP70和CD38蛋白表达(阳性表达提示预后不良);免疫球蛋白基因突变状态(突变型预后好于非突变型);细胞遗传学检测(13q14缺失预后好而17p13缺失预后差)。
另外年龄也是一个不良预后因素,CLL/SLL是一个老年性疾病,55岁以下的患者表现为临床惰性的比例低,而转化为侵袭性淋巴瘤的比例则明显增高。
个人经验:病理形态学判断预后的价值较小,所以告诉患者CLL/SLL临床惰性预后较好时要留有余地,万一具有遗传学不良预后指标时好和病人解释。
CLL/SLL的特征总结:CD20阳+CD5阳+CD23阳并呈模糊的结节状分布。
【来源:轻松诊断086 微信公众号】

扫描关注微信公众号
我要评论





共0条评论