我的博文
【激荡20年】肺癌靶向治疗研究进展里程碑
随着基因组学研究的进展,与肺癌相关的基因突变,从1984年发现KRAS突变后,不断涌现,基于驱动基因的靶向药物问世引领了肺癌治疗史上的重要变革。然而,已发现的10余种肺癌相关基因突变中,至今可以为临床所用的仅仅只有表皮生长因子受体(EGFR)突变、间变性淋巴瘤激酶(ALK)融合、ROS1融合和BRAF突变等。以下分别对这些主要靶点梳理肺癌靶向治疗研究进展。
(一) EGFR突变
1. 2003年,两个大规模多中心双盲的II期临床研究IDEAL(IRESSA Dose Evaluation in Advanced Lung Cancer)结果发布,这两个研究分别由日本大阪大学医院的Fukuoka和美国斯隆.凯德琳癌症纪念研究中心的Kris主持,也称为IDEAL1和IDEAL2研究,这两个研究的主要目的在于观察易瑞沙治疗肺癌的最佳剂量和观察该药对难治性肺癌的治疗效果。在当时,IDEAL研究的意义重大,研究结果表明,对于接受过铂类治疗失败的晚期NSCLC患者,易瑞沙作为二、三线用药,具有明显的抗肿瘤效应,能减轻症状,而且安全性相当好。这一研究显示了晚期NSCLC靶向治疗的有效性1,2。
2. 2004年,两个大规模、随机、双盲、安慰剂对照的多中心III期临床试验INTACT(IRESSA NSCLC Trial Assessing Combination Treatment)研究结果发布,这两个研究分别由荷兰自由大学医学中心的Giaccone和美国范德比尔特-英格拉姆癌症中心的Johnson主持,也称为INTACT1和INTACT2研究,是继IDEAL之后易瑞沙的最重要的研究,旨在探讨易瑞沙作为肺癌一线用药的可能性以及从临床上进一步证实在实验室观察到的TKI和化疗药物联用的协同作用。然而,INTACT研究却得出了阴性结果,让人大跌眼镜。易瑞沙联合三代化疗药物在不加选择的患者中未能带来获益3,4。
3. 2004年4月,两份世界重量级的杂志《科学》和《新英格兰医学杂志》上,分别报道:EGFR突变可以预测肺癌患者对吉非替尼的敏感性。这两项里程碑式的研究,拉开了肺癌精准靶向治疗的序幕5,6。
4. 2005年,首次报道EGFR-T790M突变介导了吉非替尼的耐药7。
5. 2005年,两项大型III期研究BR21和ISEL(IRESSA Survival Evaluation in Lung Cancer)结果发布,分别进行了厄洛替尼和吉非替尼对比安慰剂治疗既往接受过治疗的晚期NSCLC患者,结果显示,厄洛替尼可显著延长中位总生存,而吉非替尼在总体人群却未显示出生存优势,但在亚裔和无吸烟史人群中被证明可以改善生存。因没有证实在非选择人群的疗效优于安慰剂,吉非替尼在美国黯然撤市8,9。
6. 2008年,IPASS研究结果在欧洲肿瘤学年会(ESMO)上发布,这项针对非吸烟或少量吸烟腺癌患者采用吉非替尼与紫杉醇卡铂一线治疗的研究,揭示了EGFR突变在患者选择上的重要作用。在EGFR突变的患者中,吉非替尼比化疗进展或死亡风险降低了52%(HR=0.48;95%CI 0.36-0.64,P<0.0001)。2009年,IPASS研究结果正式发表在《新英格兰医学》杂志。IPASS研究不仅拯救了吉非替尼,更是开创了靶向治疗药物临床研发新模式,即先有靶点再进行验证的新思路,为各类靶向药物的临床研究道路拨开了重重迷雾10。
7. 继IPASS之后,来自韩国、日本、欧洲多个随机对照临床研究显示,一代EGFR-TKI(厄洛替尼或吉非替尼)对比化疗可显著改善患者的无进展生存期(PFS),且3级或以上不良反应显著低于化疗,奠定了厄洛替尼和吉非替尼在EGFR突变型晚期NSCLC一线治疗的地位。一代EGFR-TKI对比含铂化疗用于EGFR突变型晚期NSCLC治疗的III期研究总结见下表。
研究 | 治疗 | N | PFS |
IPASS10 | 吉非替尼 vs 紫杉醇卡铂 | 1217 | 进展或死亡风险HR=0.48;95%CI 0.36-0.64,P<0.0001 |
First-SIGNAL11 | 吉非替尼 vs 吉西他滨顺铂 | 309 | 中位(月):8.0 vs 6.3 (P=0.086) |
WJTOG340512 | 吉非替尼 vs 多西他赛顺铂 | 172 | 中位(月):9.2 vs 6.3 (P<0.0001) |
NESJOG00213 | 吉非替尼 vs 紫杉醇卡铂 | 230 | 中位(月):10.8 vs 5.4 (P<0.001) |
EURTAC14 | 厄洛替尼 vs 铂类为基础的化疗 | 174 | 中位(月):9.7 vs 5.2 (P<0.0001) |
OPTIMAL15 | 厄洛替尼vs 吉西他滨卡铂 | 165 | 中位(月):13.1 vs 4.6 (P<0.0001) |
ENSURE16 | 厄洛替尼vs 吉西他滨顺铂 | 317 | 中位(月):11.0 vs 5.5 (P<0.0001) |
8. EGFR-TKI在经过中位8-13月的疾病控制后,最终会出现耐药。2010年,Jackman在《J Clin Oncol》杂志上发表了关于EGFR-TKI获得性耐药的定义:(1)既往接受过EGFR-TKI单药(厄洛替尼或吉非替尼)治疗;(2)符合以下标准之一:EGFR活化突变或EGFR-TKI治疗后有临床客观获益(包括完全缓解、部分缓解或是超过6个月的疾病稳定)已知有EGFR突变肿瘤且对EGFR-TKI敏感;(3)病情进展后(不包括单纯中枢神经系统复发),EGFR-TKI停药的药物洗脱期不超过30天;(4)停用EGFR-TKI及开始新的治疗方法之间,无其他全身治疗措施17。
9. 2013年,二代EGFR-TKI 阿法替尼对比化疗(培美曲塞顺铂)的III期临床研究Lux-Lung3结果发表,二代EGFR-TKI阿法替尼相对化疗显著提高了PFS(11.1月 vs 6.9月,P<0.001)18. 阿法替尼虽为二代EGFR-TKI,却不能克服一代TKI的耐药。
10. 2014年,在亚洲人群中进行的二代EGFR-TKI 阿法替尼对比化疗(培美曲塞顺铂)的III期临床研究Lux-Lung6结果发表,再次证明二代EGFR-TKI阿法替尼相对化疗显著提高了PFS(11.0月 vs 5.6月,P<0.0001)19.
11. 一代EGFR-TKI最终会出现耐药,耐药后的治疗成为临床关注的热点。2013年,广东省人民医院吴一龙教授团队根据患者的临床进展模式选择将EGFR-TKI进展患者分为三种类型:局部进展型、缓慢进展型和快速进展型,并提出了不同进展类型患者的临床处理策略。局部进展的患者推荐继续EGFR-TKI联合局部治疗;缓慢进展的患者推荐继续EGFR-TKI治疗;快速进展的患者推荐含铂双药化疗20。对于缓慢进展型患者,前瞻性研究ASPIRATION探索了在EGFR突变晚期NSCLC患者中,一线厄洛替尼在缓慢进展后继续使用厄洛替尼的疗效;结果显示继续用药患者中位PFS在11月(PFS1)的基础上延长到14.1月,获得3.1月的PFS获益21。
12. 对于EGFR-TKI耐药的患者,化疗仍为多数患者的治疗选择。在化疗的基础上继续使用EGFR-TKI是否能为进一步使患者获益尚有争议。2014年在ESMO 大会上公布了IMPRESS研究的结果。IMPRESS 研究是第一项且唯一一项随机、双盲、安慰剂对照的Ⅲ期研究,在EGFR突变患者一线吉非替尼耐药后的患者中对比了化疗和化疗联合吉非替尼的疗效。吉非替尼治疗组对比对照组PFS 并无显著改善(HR=0.86,95%CI 0.65-1.13,P=0.273);中位PFS 均为5.4 个月。2015年WCLC会议上再次公布了该研究血浆检测的结果,在一代EGFR-TKIs耐药后,如果血浆T790M阳性,在化疗基础上继续使用一代EGFR-TKIs并没有益处,而血浆T790M阴性者有可能从这种治疗模式中获益。这一结果提示我们,对于TKI耐药的患者,需要区别EGFR-TKIs的不同耐药机制来施以不同的克服耐药策略,而不能把所有耐药后患者混为一谈22。
13. 随着检测技术的提高,EGFR-TKI耐药机制逐渐明确。其中,T790M突变是最常见的耐药机制,约占患者的50%甚至更高23。三代EGFR-TKI特异性靶向EGFR敏感突变和T790M突变,可以克服一代和二代EGFR-TKI耐药后T790M突变的患者。2015年,三代EGFR-TKI AZD9291的I期临床研究AURA结果发表,I期扩展队列中,127例可以评价疗效的T790M突变患者,ORR为61%(95%CI,52-70),中位PFS为9.6m;但对T790M突变阴性患者,AZD9291的ORR和中位PFS分别仅为21%和2.8月24。2015年11月,AZD9291获得美国FDA批准用于一代或二代EGFR-TKIs,如吉非替尼,厄洛替尼和阿法替尼耐药后T790M突变的NSCLC,后续分别在欧洲,日本和韩国获批。在欧洲,同时还批准了药物的伴随诊断,组织或血浆EGFR检测均可。2016年9月,美国FDA批准,当无法获得组织活检时,可以采用血液EGFR突变检测。
14. 2016年,AZD9291的II期研究结果发表,两个II期研究(AURA extension:和AURA2)入组了EGFR-TKI耐药后T790M突变的患者。AURA2研究中,210例患者接受奥希替尼治疗,确认的ORR为70%,mPFS为9.9m(95%CI,8.5-12.3m)25。
15. 为确认单臂II期研究的结果,进行了随机III期研究AURA3。这一研究入组了一线EGFR-TKI治疗进展后合并T790M突变的NSCLC。研究结果在2016年世界肺癌大会上发布,《新英格兰医学杂志》几乎同期发布。研究共419例患者参与随机,分别接受奥希替尼(n=279)和培美曲塞铂类(n=140)治疗。奥希替尼组和培美曲塞铂类组的mPFS分别为10.1m和4.4m(HR=0.30, 95% CI 0.23–0.41, p < 0.001)。在基线合并脑转移的患者中,两组的mPFS分别为8.5m和4.2m(HR=0.32, 95% CI 0.21–0.49)26。2017年3月,奥希替尼获得cFDA批准用于EGFR-TKI耐药后T790M突变型晚期NSCLC治疗的三代EGFR-TKI。
16. 为了能在EGFR-TKI治疗的基础上进一步为患者带来获益,已进行了大量的联合治疗模式的探索,包括在EGFR-TKI治疗的基础上联合化疗或者贝伐珠单抗。EGFR-TKI联合化疗模式包括了化疗联合交替或者每日EGFR-TKI。2013年发布的III期随机对照研究FASTACT-2研究,对比化疗联合交替厄洛替尼和单纯化疗一线治疗晚期NSCLC,在EGFR突变患者中显示联合治疗组中位PFS和OS均显著优于单纯化疗(中位PFS:16.8月vs.6.9月,P<0.001;中位OS:31.4月vs.20.6,P=0.0092),联合治疗组的中位PFS和OS也较单药EGFR-TKI历史数据有提高27。2015年WCLC 会议上发布了JMIT研究的结果。这项II期随机对照研究,纳入初治EGFR敏感突变型非鳞NSCLC患者,入组患者2:1随机分配接受吉非替尼+培美曲塞(G+P)和吉非替尼(G)单药,主要研究终点为评估一线吉非替尼联合培美曲塞较吉非替尼单药能否延长患者PFS。研究共入组191例患者,G+P联合组的中位PFS相对G单药组显著延长近5个月(15.8个月 vs. 10.9个月; HR=0.68,95% CI, 0.48-0.96; P=0.029)28。
17. 2014年,厄洛替尼联合抗血管生成(贝伐珠单抗)的II期研究发布,结果显示,厄洛替尼联合贝伐珠单抗用于EGFR突变的晚期NSCLC,相比厄洛替尼单药,可以显著延长PFS(16.0月 vs 9.7月,HR=0.54;P=0.0015)29。2017年,另一项厄洛替尼联合贝伐珠单抗的II期研究BELIEF,结果显示总体人群的中位PFS为13.2个月,其中T790M阳性患者和阴性患者的mPFS分别为16.0个月和10.5个月30。值得关注的是,贝伐珠单抗联合厄洛替尼对比单药厄洛替尼治疗伴有EGFR突变的晚期非鳞NSCLC的III期随机对照研究CTONG1509正在进行中。
18. 2016年,国产EGFR-TKI埃克替尼用于EGFR突变型晚期NSCLC一线治疗的III期临床研究CONVINCE结果在ASCO大会上公布。比较埃克替尼vs培美曲塞顺铂联合培美曲塞维持治疗用于EGFR突变型晚期肺腺癌一线治疗。共285例患者接受治疗,其中埃克替尼组148例,化疗组137例。埃克替尼组肺癌患者PFS相比化疗组有较大提升,分别为296天 vs 219天31。
19. 2017年,第一项二代EGFR TKI对比一代EGFR TKI的III期临床试验ARCHER1050研究公布,结果显示,Dacomitinib显著优于吉非替尼,两组的mPFS分别为14.7个月和9.2个月(HR 0.59;95%CI 0.47-0.74;P<0.0001)。Dacomitinib成为EGFR突变阳性晚期NSCLC一线治疗新选择。然而,Dacomitinib的毒性不容忽视32。
20. 2017年,第一项三代EGFR TKI对比一代EGFR TKI的III期临床试验FLAURA研究公布。在全分析集中,奥希替尼组和标准治疗组的mPFS分别为18.9个月和10.2个月(HR 0.46;95%CI 0.37-0.57;P<0.001)。在基线伴有中枢神经系统转移的患者中,奥希替尼组也显著优于标准治疗,两组mPFS分别为15.2个月和9.7个月(HR 0.47;95%CI 0.30-0.74;P<0.001)。初步的生存分析数据提示奥希替尼组有OS获益的趋势,期待成熟的总生存数据。基于FLAURA研究,奥希替尼成为EGFR突变阳性晚期NSCLCL患者的一线治疗新标准,然而一代、二代和三代EGFR TKI的最佳使用顺序仍有待探索。33
辅助靶向:
1. 2013年,BR19研究结果正式公布,研究最终入组了503例未加选择的完全切除的IB-IIIA期NSCLC患者,按分期、组织学类型、术后放疗、性别、辅助化疗方案分层。1:1随机分配接受吉非替尼(250mg/d,n=251) 和安慰剂(n=252)治疗。最终的结果是两组的总体人群OS和DFS都无显著性差异,吉非替尼组的生存曲线整个轨迹甚至都在安慰剂组的下方34。
2. 2014年ASCO大会,RADIANT研究结果公布。BR21研究入组完全切除的ⅠB-ⅢA期NSCLC患者(要求为EGFR IHC/FISH阳性人群),以2:1随机接受厄洛替尼(150mgqd,连用2年)和安慰剂。主要终点为无疾病生存期(DFS)。2007年11月至2010年7月,共随机入组973例患者。结果显示用药组和安慰剂组的DFS无显著性差异。在161名(16.5%)例EGFR突变的患者中,厄洛替尼能够增加患者的获益(46.4m vs 28.5m,HR=0.61,p=0.039),但在分层检验中该结果并没有达到显著的水平。结论:辅助厄洛替尼治疗并不能够延长表达EGFR的NSCLC患者和EGFR突变阳性患者的DFS。对EGFR突变阳性患者能否从中获益值得进一步研究35。
3. 2017年ASCO大会上,由中国胸部肿瘤研究协作组(CTONG)启动的国内多中心随机对照临床试验ADJUVANT研究(CTONG1104研究)结果重磅发布。研究招募了术后病理证实胸内淋巴结转移(N1/N2阳性)的EGFR突变患者,接受R0切除后,进行术后辅助吉非替尼2年对比传统长春瑞滨/顺铂化疗,终点指标是DFS。结果显示,辅助吉非替尼组对比辅助化疗组,显著延长DFS,mDFS分别为28.7个月和18.0个月(HR 0.60;95%CI 0.42-0.87;P=0.005)。ADJUVANT研究开启了肺癌辅助靶向治疗的新纪元36。
4. 2017年WCLC会议上,另一项由中国研究者发起的II期临床试验EVAN研究结果公布,研究入组完全性切除术后的IIIA期EGFR突变型NSCLC患者中,评估辅助厄洛替尼对比辅助长春瑞滨顺铂(NP)化疗的疗效和安全性。结果显示,厄洛替尼组和NP组2年的DFSR分别为81.35% (95%CI: 69.63-93.08)和44.62% (95%CI: 26.86-62.38),差异有统计学意义(P<0.001)。厄洛替尼组的中位DFS显著长于NP组,中位DFS分别为42.42个月 vs. 20.96个月,HR 0.271, 95% CI: 0.137-0.535; P<0.001。EVAN研究结果印证了ADJUVANT研究,为辅助靶向治疗再添新证据。
5. EGFR TKI用于早期NSCLC辅助治疗,探索还在继续,值得期待的研究如下:
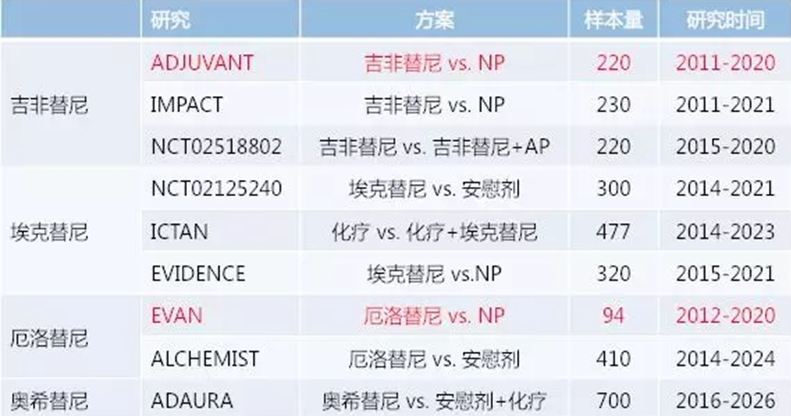
(二)ALK重排
1. 2007年,日本学者Soda等首次在1例吸烟的男性肺腺癌患者标本中发现了EML4-ALK融合基因。研究者在该患者标本中扩增出由EML4与ALK融合的DNA片段。EML4基因断裂后与ALK基因的20号外显子融合,形成EML4-ALK融合基因inv(2)(p21p23)。临床前研究证实具有EML4-ALK融合基因的肿瘤均依赖ALK基因及其下游的RAS-MAPK及PI3K-AKT及JAK-STST通路活化来驱动和维持其生长,ALK抑制剂能显著抑制其生长37。
2. 克唑替尼(crizotinib)是一种小分子ATP竞争性抑制剂,对ALK, c-MET 和ROS1驱动的肿瘤具有选择性抑制作用。克唑替尼的Ⅰ期临床试验PROFILE 1001分两部分。第一部分为剂量爬坡试验,确定了克唑替尼的最大耐受剂量为250mg bid,并且观察到ALK重排患者临床获益明显。试验的第二部分仅纳入ALK FISH阳性的患者。2010年,研究结果发布,该部分可评价疗效的患者共82例,其中ORR为57%,DCR为90%38。2011年8月26日,美国FDA批准了克唑替尼用于ALK FISH阳性的局部晚期或转移性非小细胞肺癌患者。
3. 2012年,研究者更新了PROFILE 1001及其拓展试验的数据,入组149例ALK阳性患者,其中143人可评价疗效,ORR为60.8%(87/143),其中3例完全缓解(CR),84例部分缓解(PR)。中位PFS为9.7m(95%CI 7.7-12.8)。克唑替尼主要的毒副作用是视觉损伤,胃肠道副反应和间质性肺炎39。
4. 2012年,克唑替尼的II期临床研究PROFILE1005结果发布。该研究纳入ALK FISH 阳性,既往化疗失败的非小细胞肺癌患者,主要研究终点为ORR。85%的患者既往接受过多线化疗(≥2种化疗方案)。入组患者可以评价疗效的有261人,其中ORR为60%(95%CI:54-66),中位疗效持续时间为46周,中位PFS为8.1m (95%CI:6.8-9.7) 40。
5. 2013年,克唑替尼的III期临床试验PROFILE1007结果发表。PROFILE1007比较克唑替尼和培美曲塞或多西他赛二线治疗晚期ALK重排NSCLC患者。PROFILE 1007共入组347人,接受克唑替尼和接受化疗患者的ORR分别为65%和20%(P<0.001)。克唑替尼组患者的PFS明显优于化疗组,7.7m vs. 3.0m(HR=0.49, P<0.001)。PROFILE1007的试验结果奠定了克唑替尼用于ALK重排NSCLC患者的二线治疗地位41。
6. 2014年,克唑替尼用于ALK重排NSCLC一线治疗的研究PROFILE1014结果发表。PROFILE1014研究是一线克唑替尼与化疗头对头的比较III期临床研究,入组343例ALK重排NSCLC患者随机接受克唑替尼和培美曲塞顺铂(或卡铂)化疗。克唑替尼组和化疗组的ORR分别为74%和45%(P<0.001),PFS分别为10.9m和7.0m(HR=0.45, 95%CI: 0.35-0.60, P<0.001)。克唑替尼与化疗的一线对比奠定了克唑替尼用于ALK重排NSCLC患者的一线治疗地位42。
7. 2014年,克唑替尼一线治疗ALK阳性NSCLC患者的中位PFS位11个月左右,获得性耐药机制主要为ALK激酶域的二次突变(22-33%);EGFR通路活化(30-35%)和其他未知的机制等23。
8. 2014年,二代ALK抑制剂Ceritinib用于ALK阳性患者的I期临床研究结果发布。入组患者中,80例为克唑替尼耐药患者,接受Ceritinib治疗的ORR为56%,中位PFS位7.0个月。无论患者有无ALK激酶区的二次突变,都能从Ceritinib治疗中获益43。2014年,Ceritinib获得美国FDA批准用于克唑替尼耐药后的ALK阳性NSCLC 。2015年,一项回顾性研究表明,晚期ALK重排非小细胞肺癌患者序贯应用一代和二代ALK抑制剂(Ceritinib),患者的中位OS可达49.4m (95%CI:35.3-63.1)44。
9. 2014年,另一二代ALK抑制剂Alectinib用于克唑替尼耐药的ALK阳性患者的I期临床研究AF-002JG结果发布。在44例可评价疗效的患者中,ORR为55%;在21例基线有脑转移的患者,11例(52%)取得客观缓解45。2016年,Alectinib用于克唑替尼耐药的ALK阳性患者的II期临床研究公布,确认的ORR为48%46。2015年,Alectinib获得美国FDA批准用于克唑替尼耐药后的ALK阳性NSCLC。
10. 2016年,PROFILE 1029试验结果在ASCO发布。这一随机、开放、双臂III期临床研究,旨在评价在东亚人群,克唑替尼一线治疗既往未经过系统性治疗的ALK阳性NSCLC患者的疗效和安全性。PROFILE1029研究设计与PROFILE1014研究相似,但是患者人群不一样。最终入组207例患者,其中中国患者183例。研究达到了主要研究终点,即在东亚人群,与标准含铂双药化疗相比,克唑替尼组患者的无进展生存期(PFS)显著延长(中位PFS 为11.1个月 vs 6.8个月;HR = 0.39;95%CI, 0.28-0.56;P <0.0001),肿瘤缓解率明显提高(88% vs 46%;P <0.0001)47。
11. 2016年ASCO大会,Alectinib对比克唑替尼用于ALK阳性晚期NSCLC的III期临床研究J-ALEX发表。研究入组207例患者。其中Alectinib组103例,Crizotinib组104例,允许患者既往接受过<=1线化疗。独立评估委员会评价的Alectinib组和Crizotinib组的ORR分别为91.6%和78.9%;中位PFS分别为未达到(95%CI:20.3-未达到)和10.2m(95%CI:8.2-12.0)(HR=0.34;99.6826% CI:0.17-0.70)。在预先设定的中期评估中,因为已经看到了Alectinib绝对的优势,独立评审建议提前终止trial并且释放数据。据估计,ALC的PFS可能超过24.3m,研究者认为Alectinib有潜力冲进ALK阳性患者的标准一线治疗48。
12. 2016年WCLC会议,Ceritinib对比含铂双药化疗一线治疗ALK阳性NSCLC的III期研究发布。研究入组376例ALK阳性晚期NSCLC,1:1随机接受Ceritinib(n=189)或培美曲塞铂类化疗(n=187)治疗,两组的中位PFS分别位16.6月和8.1个月(HR=0.55;P<0.0001)。研究结果显示ALK阳性的晚期NSCLC,一线Ceritinib显著优于化疗49。
13. 2017年ASCO大会,Alectinib对比克唑替尼用于ALK阳性晚期NSCLC的全球III期临床研究ALEX发表。与J-ALEX研究相比,ALEX研究在设计上稍有不同,入组的患者均为初治的晚期NSCLC,允许脑转移患者入组,且作为分层因素,并计划分析至CNS进展时间,所有患者均接受Alcetinib 600mg,BID治疗。结果显示,Alcetinib对比克唑替尼,显著延长PFS,独立评估委员会评估的mPFS,两组分别为25.7个月和10.4个月(HR 0.50;95%CI 0.36-0.70;P<0.0001)50。基于ALEX研究结果,Alectinib被推荐作为ALK阳性晚期NSCLC一线治疗的优选。
14. 2017年,三代ALK抑制剂Lorlatinib用于ALK或ROS1阳性的晚期NSCLC的第一项I期临床试验结果公布。结果显示,对既往接受过ALK抑制剂治疗后产生耐药突变的患者(如G1202R),Lorlatinib同样有效。在ALK阳性患者中,Lorlatinib的ORR为46%,颅内为ORR42%,mPFS为9.6个月;在ROS1阳性的患者中,Lorlatinib的ORR为50%。这一研究提示,Lorlatinib用于既往一代或二代ALK抑制剂耐药的患者显示出较好的疗效51。目前,Lorlatinib对比克唑替尼用于ALK阳性晚期NSCLC一线治疗的III期临床试验CROWN正在进行。
(三)ROS1重排
1. ROS1基因可表达一个与ALK相关的罕见酪氨酸激酶 ,属于胰岛素受体家族。与其他的酪氨酸激酶受体类似,ROS1 融合基因也可激活细胞生长和存活的信号传导通路。大约1–2% 的NSCLC中具有ROS1 基因重排52。
2. 2014年,Alice Shaw报道了克唑替尼用于ROS1阳性患者的I期 PROFILE 1001研究。 研究入组了50例ROS重排的晚期NSCLC,接受克唑替尼治疗后,疗效显著,ORR为72%,中位PFS为19.6个月53。2016年3月11日美国FDA扩展了克唑替尼的适应证,批准克唑替尼用于ROS1阳性转移性NSCLC的治疗。
3. 2015年,欧洲的一项回顾性研究分析了31例ROS1阳性的NSCLC患者,接受克唑替尼治疗的ORR为80%,PFS为9.1个月54。
4. 2015年,WCLC会议上报道了法国的一项II期研究队列分析结果,入组37例ROS1阳性的NSCLC患者,接受克唑替尼治疗的ORR为69%,PFS为9.1个月50。
5. 2016年ASCO大会和CSCO大会报道ROS1用于东亚人群的临床研究。这是一项在东亚人群中评估克唑替尼治疗ROS1重排阳性晚期NSCLC患者的单臂的II期研究。研究共入组了127例ROS1阳性的晚期NSCLC(采用RT-PCR法检测ROS1融合),克唑替尼的ORR为88%,中位PFS约为13.4个月51。
6. 2017年,Ceritinib用于ROS1融合的晚期NSCLC的II期临床研究公布。研究入组32例ROS1阳性的患者,其中28例可以评价疗效。在总体人群中,Ceritinib的ORR为62%,mPFS为9.3个月;在既往未接受过克唑替尼治疗的患者中,Ceritinib的ORR为66%,mPFS为19.3个月。这一研究提示,Ceritinib用于既往经过多线治疗的ROS1融合的晚期NSCLC,显示出较好的临床疗效,期待进一步研究55。
(四)BRAF突变
BRAF V600E突变在肺腺癌中的发生率为1-2%。2017年,Dabrafenib 联合Trametinib用于BRAF V600E突变型NSCLC的II期临床研究结果公布。研究入组36例BRAF V600E突变的晚期NSCLC,接受一线Dabrafenib 联合Trametinib治疗,结果显示,研究者确认的ORR为64%,mPFS为10.9个月,mOS为24.6个月56。2017年6月,Dabrafenib 联合Trametinib已经批准用于BRAF V600E突变型晚期NSCLC。
总结最近十余年来,分子病理学的巨大进步已经使我们对 NSCLC 潜在病理机制及显著异质性的理解有了很大进展。具体到临床实践,对肿瘤组织进行这类驱动突变的分子检测已经成为了常规。目前而言,大部分肿瘤中仍未检测到驱动突变,因此对这类患者仍为细胞毒性化疗经验性治疗。对于具有已知驱动性突变的非小细胞肺癌患者,靶向治疗表现出了显著临床获益,但获得性耐药仍常见。未来,将在克服靶向耐药,优化靶向治疗(如联合免疫治疗等)以及新靶点探寻上继续前行。 参考文献
1. Fukuoka M, Yano S, Giaccone G, et al: Multi-institutional randomized phase II trial of gefitinib for previously treated patients with advanced non-small-cell lung cancer (The IDEAL 1 Trial) [corrected]. J Clin Oncol 21:2237-46, 2003
2.Kris MG, Natale RB, Herbst RS, et al: Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer: a randomized trial. Jama 290:2149-58, 2003
3.Giaccone G, Herbst RS, Manegold C, et al: Gefitinib in combination with gemcitabine and cisplatin in advanced non-small-cell lung cancer: a phase III trial--INTACT 1. J Clin Oncol 22:777-84, 2004
4.Herbst RS, Giaccone G, Schiller JH, et al: Gefitinib in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer: a phase III trial--INTACT 2. J Clin Oncol 22:785-94, 2004
5.Lynch TJ, Bell DW, Sordella R, et al: Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 350:2129-39, 2004
6.Paez JG, Janne PA, Lee JC, et al: EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 304:1497-500, 2004
7.Kobayashi S, Boggon TJ, Dayaram T, et al: EGFR mutation and resistance of non-small-cell lung cancer to gefitinib. N Engl J Med 352:786-92, 2005
8.Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al: Erlotinib in Previously Treated Non–Small-Cell Lung Cancer. New England Journal of Medicine 353:123-132, 2005
9.Thatcher N, Chang A, Parikh P, et al: Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). The Lancet 366:1527-1537
10.Mok TS, Wu YL, Thongprasert S, et al: Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 361:947-57, 2009
11. Han JY, Park K, Kim SW, et al: First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol 30:1122-8, 2012
12.Mitsudomi T, Morita S, Yatabe Y, et al: Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. The Lancet Oncology 11:121-128
13.Maemondo M, Inoue A, Kobayashi K, et al: Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 362:2380-8, 2010
14.Rosell R, Carcereny E, Gervais R, et al: Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 13:239-46, 2012
15.Zhou C, Wu YL, Chen G, et al: Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 12:735-42, 2011
16. Wu YL, Zhou C, Liam CK, et al: First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Ann Oncol 26:1883-9, 2015
17.Jackman D, Pao W, Riely GJ, et al: Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer. J Clin Oncol 28:357-60, 2010
18.Sequist LV, Yang JC, Yamamoto N, et al: Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 31:3327-34, 2013
19.Wu YL, Zhou C, Hu CP, et al: Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 15:213-22, 2014
20.Yang JJ, Chen HJ, Yan HH, et al: Clinical modes of EGFR tyrosine kinase inhibitor failure and subsequent management in advanced non-small cell lung cancer. Lung Cancer 79:33-9, 2013
21. Park K, Yu CJ, Kim SW, et al: First-Line Erlotinib Therapy Until and Beyond Response Evaluation Criteria in Solid Tumors Progression in Asian Patients With Epidermal Growth Factor Receptor Mutation-Positive Non-Small-Cell Lung Cancer: The ASPIRATION Study. JAMA Oncol 2:305-12, 2016
22.Soria JC, Wu YL, Nakagawa K, et al: Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS): a phase 3 randomised trial. Lancet Oncol 16:990-8, 2015
23.Camidge DR, Pao W, Sequist LV: Acquired resistance to TKIs in solid tumours: learning from lung cancer. Nat Rev Clin Oncol 11:473-81, 2014
24. Janne PA, Yang JC, Kim DW, et al: AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med 372:1689-99, 2015
25.Goss G, Tsai CM, Shepherd FA, et al: Osimertinib for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol 17:1643-1652, 2016
26. Mok TS, Wu Y-L, Ahn M-J, et al: Osimertinib or Platinum–Pemetrexed in EGFR T790M–Positive Lung Cancer. New England Journal of Medicine, 2016
27.Wu YL, Lee JS, Thongprasert S, et al: Intercalated combination of chemotherapy and erlotinib for patients with advanced stage non-small-cell lung cancer (FASTACT-2): a randomised, double-blind trial. Lancet Oncol 14:777-86, 2013
28.Cheng Y, Murakami H, Yang PC, et al: Randomized Phase II Trial of Gefitinib With and Without Pemetrexed as First-Line Therapy in Patients With Advanced Nonsquamous Non-Small-Cell Lung Cancer With Activating Epidermal Growth Factor Receptor Mutations. J Clin Oncol 34:3258-66, 2016
29.Seto T, Kato T, Nishio M, et al: Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 15:1236-44, 2014
30.Rosell R, Dafni U, Felip E, et al: Erlotinib and bevacizumab in patients with advanced non-small-cell lung cancer and activating EGFR mutations (BELIEF): an international, multicentre, single-arm, phase 2 trial. Lancet Respir Med 5:435-444, 2017
31.Yuankai Shi LW, Baohui Han, Wei Li, Ping Yu, Yunpeng Liu, Cuimin Ding, Xia Song, Ma Zhi Yong, Xinling Ren, Ji Feng Feng, Helong Zhang, Gongyan Chen, Ning Wu, Xiaohong Han, Chen Yao, Yong Song, Shucai Zhang, Lieming Ding, Fenlai Tan.: First-line icotinib versus cisplatine/pemetrexed plus pemetrexed maintenance therapy in lung adenocarcinoma patients with sensitizing EGFR mutation (CONVINCE). J Clin Oncol 34:suppl; abstr 9041, 2016
32.Wu YL, Cheng Y, Zhou X, et al: Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 18:1454-1466, 2017
33.Soria JC, Ohe Y, Vansteenkiste J, et al: Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med 378:113-125, 2018
34.Goss GD, O'Callaghan C, Lorimer I, et al: Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR19 study. J Clin Oncol 31:3320-6, 2013
35.Kelly K, Altorki NK, Eberhardt WE, et al: Adjuvant Erlotinib Versus Placebo in Patients With Stage IB-IIIA Non-Small-Cell Lung Cancer (RADIANT): A Randomized, Double-Blind, Phase III Trial. J Clin Oncol 33:4007-14, 2015
36.Zhong WZ, Wang Q, Mao WM, et al: Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study. Lancet Oncol 19:139-148, 2018
37.Soda M, Choi YL, Enomoto M, et al: Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 448:561-6, 2007
38.Kwak EL, Bang YJ, Camidge DR, et al: Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med 363:1693-703, 2010
39.Camidge DR, Bang YJ, Kwak EL, et al: Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancet Oncol 13:1011-9, 2012
40.Kim D, Ahn M, Yang P, et al: updated results of a global phase II study with crizotinib in advanced ALK-positive non-small cell lung cancer(NSCLC). Annals of Oncology 23:402-402, 2012
41.Shaw AT, Kim DW, Nakagawa K, et al: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 368:2385-94, 2013
42. Solomon BJ, Mok T, Kim DW, et al: First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 371:2167-77, 2014
43. Shaw AT, Kim DW, Mehra R, et al: Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 370:1189-97, 2014
44. Gainor JF, Tan DS, De Pas T, et al: Progression-Free and Overall Survival in ALK-Positive NSCLC Patients Treated with Sequential Crizotinib and Ceritinib. Clin Cancer Res 21:2745-52, 2015
45.Gadgeel SM, Gandhi L, Riely GJ, et al: Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer (AF-002JG): results from the dose-finding portion of a phase 1/2 study. Lancet Oncol 15:1119-28, 2014
46. Shaw AT, Gandhi L, Gadgeel S, et al: Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 17:234-42, 2016
47.Shun Lu TM, You Lu, Jianying Zhou, Yuankai Shi, Virote Sriuranpong, James C. M. Ho, Choo Khoon Ong, Chun-Ming Tsai, Chin-Hee Chung, Keith D. Wilner, Yiyun Tang, Elizabeth Masters, Paulina Selaru, Yi-Long Wu: Phase 3 study of first-line crizotinib vs pemetrexed−cisplatin/carboplatin (PCC) in East Asian patients (pts) with ALK+ advanced non-squamous non-small cell lung cancer (NSCLC). J Clin Oncol 34:suppl; abstr 9058, 2016
48.Hiroshi Nokihara TH, Masashi Kondo, Young Hak Kim, Koichi Azuma, Takashi Seto, Yuichi Takiguchi, Makoto Nishio, Hiroshige Yoshioka, Fumio Imamura, Katsuyuki Hotta, Satoshi Watanabe, Koichi Goto, Kazuhiko Nakagawa, Tetsuya Mitsudomi, Nobuyuki Yamamoto, Hiroshi Kuriki, Ryoichi Asabe, Tomohiro Tanaka, Tomohide Tamura: Alectinib (ALC) versus crizotinib (CRZ) in ALK-inhibitor naive ALK-positive non-small cell lung cancer (ALK+ NSCLC): Primary results from the J-ALEX study. J Clin Oncol 34:suppl; abstr 9008, 2016
49. Soria JC, Tan DS, Chiari R, et al: First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 389:917-929, 2017
50.Peters S, Camidge DR, Shaw AT, et al: Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 377:829-838, 2017
51. Shaw AT, Felip E, Bauer TM, et al: Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open-label, single-arm first-in-man phase 1 trial. Lancet Oncol 18:1590-1599, 2017
52.Bergethon K, Shaw AT, Ou SH, et al: ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 30:863-70, 2012
53. Shaw AT, Ou SH, Bang YJ, et al: Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 371:1963-71, 2014
54.Mazieres J, Zalcman G, Crino L, et al: Crizotinib therapy for advanced lung adenocarcinoma and a ROS1 rearrangement: results from the EUROS1 cohort. J Clin Oncol 33:992-9, 2015
55. Lim SM, Kim HR, Lee JS, et al: Open-Label, Multicenter, Phase II Study of Ceritinib in Patients With Non-Small-Cell Lung Cancer Harboring ROS1 Rearrangement. J Clin Oncol 35:2613-2618, 2017
56.Planchard D, Smit EF, Groen HJM, et al: Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 18:1307-1316, 2017
我要评论




共0条评论