我的博文
免疫组织化学标志物在泌尿生殖系统肿瘤诊断中的应用和进展
作者:程亮 赵明 王丽莎
作者单位:46202 美国印第安纳大学医学院病理科(程亮);浙江省人民医院病理科(赵明);复旦大学附属肿瘤医院病理科(王丽莎)
《中华病理学杂志》2015年5月第5期
一、前言
应用免疫组织化学技术进行肿瘤标志物的研究,近年来已逐步推广应用于病理学诊断领域。泌尿生殖系统肿瘤的组织学分类、良恶性肿瘤的区分以及肿瘤和非肿瘤性疾病的鉴别诊断是病理医生在临床实践中经常遇到的重点和难点,往往需要免疫组织化学技术来辅助诊断。另外,免疫组织化学技术对于评估肿瘤的分子遗传学特征(如Xp11.2易位性肾细胞癌,伴TMPRSS2-ERG基因融合的前列腺癌等)、监测肿瘤的预后和转归(如联合P53/Ki67/FGFR3对尿路上皮癌的危险度分级)、以及指导患者的个体化治疗也具有重要的临床意义。本文将简要介绍泌尿生殖系统肿瘤常用的以及新近认识的免疫组织化学标志物的应用进展和前景,着重强调其在诊断和鉴别诊断中的应用价值,以及在实践过程中可能存在的陷阱和误区。
二、免疫组织化学染色在膀胱肿瘤诊断中的应用
免疫组织化学染色在膀胱肿瘤诊断中的应用主要体现在以下几个方面:(1)证实转移性肿瘤或膀胱肿瘤罕见亚型的尿路上皮起源或分化;(2)鉴别尿路上皮反应性不典型增生与原位癌;(3)确定浸润性尿路上皮癌的分期(浸润深度);(4)具有梭形细胞特征的膀胱肿瘤的鉴别诊断;(5)膀胱原发性腺癌与结直肠腺癌或前列腺腺癌累及膀胱的鉴别诊断。
迄今为止,能够协助确定某一肿瘤具有尿路上皮分化的免疫组化标记物非常少见。一半以上的尿路上皮癌可显示CK7和CK20的共表达。常用的协助判断尿路上皮分化的免疫组织化学标志物有高分子量CK(34βE12)、p63、CK5/6等,但这些标志物因并非尿路上皮所特有,所以实际应用价值有限。核转录因子GATA3是新近认识并被国际泌尿病理协会(ISUP)推荐用于证实肿瘤尿路上皮分化的一线标志物之一,在尿路上皮癌中具有较高的敏感性,表达率自67%至90%不等。但值得注意的是,GATA3的尿路上皮癌中的表达特异性相对偏低,其也可在其他肿瘤中表达,如乳腺的导管癌(67%-91%)和小叶癌(近100%)。此外,皮肤基底细胞癌、滋养细胞肿瘤、卵黄囊瘤、鳞状细胞癌、间皮瘤、副神经节瘤等也可不同程度的表达GATA3。S-100P和Uroplakin II是最近涌现的尿路上皮相关的特异性标志物。S-100P可表达于近78%的尿路上皮癌,与GATA3相似,S-100P敏感性虽较强,但特异性相对较差,可表达于消化道特别是胰胆管上皮来源的肿瘤。因此,在应用GATA3和S-100P证实肿瘤的尿路上皮分化时,需结合形态学和临床资料综合判断,特别是在活检标本中应注意此潜在的诊断陷阱。Uroplakin II可表达于近80%的尿路上皮癌中,敏感性较高,特异性接近100%。UroplakinIII和血栓调节蛋白(Thrombomodulin)对于证实肿瘤的尿路上皮分化具有较高的特异性,但是敏感性较差,应用相对较少。
尿路上皮反应性不典型增生与原位癌(CIS)的鉴别诊断是泌尿病理日常实践中的难点之一,组织形态学特点是其诊断的金标准,必要时可行免疫组织化学帮助诊断。ISUP推荐使用CK20/p53/CD44s联合检测:尿路上皮CIS通常弥漫性全层表达CK20和p53,CD44s表达缺失;而尿路上皮反应性不典型增生则表现相反。Aron 等研究表明,α甲基酰基辅酶A消旋酶(AMACR,或称p504S)与CK20/p53/CD44s联合应用可用于鉴别诊断尿路上皮反应性不典型增生与CIS,AMACR在良性或反应性尿路上皮中阴性表达,而在治疗前后的CIS中均可见表达(78%和50%)。另外,Ki67和p16等对于两者的鉴别诊断价值有限。
在活检标本和经尿道切除的膀胱肿瘤组织中,识别早期浸润或者判断肿瘤的浸润深度具有重要的临床意义。当组织伴有严重烧灼伤或炎症背景明显时可造成诊断困难,此时可行免疫组织化学染色协助诊断。CK(包括广谱AE1/AE3,CK7,CK8/18等)可帮助识别组织中早期浸润的少量不规则簇状肿瘤细胞。Desmin可用于鉴别平滑肌纤维与肿瘤浸润引起的间质纤维组织增生从而判断肿瘤是否存在肌层的浸润,前者通常弥漫强阳性表达,后者不表达或仅局灶表达。值得注意的是,黏膜肌层绝不能与固有肌层的平滑肌束相混淆,此时可借助一种新的平滑肌特异性蛋白Smoothelin来判断,其在固有肌层平滑肌呈阳性表达,而在黏膜肌层阴性或弱阳。但是,smoothelin在两者之间的表达有时可存在重叠,因此在日常实践中的应用仍有待于确定。
膀胱常见的梭形细胞肿瘤或者瘤样病变包括肉瘤样癌、假肉瘤样肌纤维母细胞增生/炎性肌纤维母细胞肿瘤(Pseudosarcomatousmyofibroblastic proliferation / Inflammatory myofibroblatic tumor,PMP/IMT)、平滑肌肉瘤、横纹肌肉瘤等。ISUP推荐联合使用的一组免疫组织化学标志物包括间变性淋巴瘤激酶1(ALK-1)、SMA、desmin、AE1/AE3、p63、高分子量CK(34βE12)和/或CK5/6。其中PMP/IMT可有特征性的SMA强阳性表达呈围绕梭形肿瘤细胞长轴边界的双轨征表达模式)及与AE1/AE3的共表达;20%-89%的病例ALK-1为阳性。平滑肌肉瘤表达SMA和/或desmin,横纹肌肉瘤表达myogenin或MyoD1。因PMP/IMT及平滑肌肉瘤偶可局灶表达AE1/AE3,在活检标本中需注意与肉瘤样癌的鉴别。最新研究表明,近75%的膀胱肉瘤样癌表达GATA3,可将肉瘤样癌与其他梭形细胞肿瘤或瘤样病变区分开来。
膀胱原发性腺癌少见,主要的鉴别诊断为结直肠腺癌或前列腺腺癌累及膀胱和伴有腺样分化的尿路上皮癌。β-catenin在鉴别诊断结直肠腺癌累及膀胱和膀胱原发性腺癌时具有重要的参考价值,其在前者通常为弥漫核阳性,而在后者通常为弥漫膜阳性。CDX2在许多具有肠型分化的原发及转移性腺癌中均可表达,因此对于区分两者意义不大.Cadherin17(CDH17),也称肝-肠钙黏蛋白,是新近报道的一种用于消化道腺癌诊断的有效标记物。Rao等研究显示,Cadherin17在原发性结直肠癌、原发性膀胱腺癌和结直肠癌累及膀胱的病例中均表达较高(分别为95%、92%和92%),而在伴有腺样分化的尿路上皮癌中为阴性,因此,Cadherin17是膀胱原发性腺癌相对特异和敏感的标志物。此外,Gleason评分较高的前列腺腺癌累及膀胱时需与高级别尿路上皮癌相鉴别,详见下节前列腺癌肿瘤的免疫组化鉴别诊断。
膀胱原发性透明细胞腺癌和肾源性腺瘤/化生通常表达PAX8和AMACR,不表达GATA3,可作为与透明细胞型尿路上皮癌和微囊型尿路上皮癌的鉴别诊断标志物。
三、免疫组织化学染色在前列腺肿瘤诊断中的应用
免疫组织化学染色在前列腺肿瘤诊断中的应用主要体现在以下几个方面:(1)证实肿瘤的前列腺起源;(2)前列腺癌与良性非肿瘤性病变的区分;(3)特殊类型的前列腺癌、局限性前列腺癌和非典型腺体病变的鉴别诊断;(4)前列腺癌与转移性癌如尿路上皮癌或结直肠癌的区分;(4)肉瘤样癌与肉瘤的鉴别诊断等。
前列腺特异性抗原(PSA)及前列腺特异性酸性磷酸酶(PSAP)对于判断肿瘤起源于前列腺具有高度的特异性,但其敏感性可能随着肿瘤分化程度的降低或内分泌治疗出现明显的下降。在活检标本中将近5%-13%的低分化前列腺癌可失表达PSA或PSAP, 此时可借助其他前列腺较特异的标志物如P501s(prostein,该标志物与P504s/AMACR不同, P501s呈颗粒状广泛表达于正常及肿瘤性前列腺组织内,而P504s主要表达于前列腺癌或前列腺上皮内肿瘤内)、NKX3.1、前列腺特异性膜抗原(PSMA)或雄激素受体(AR)等来综合判断。研究表明,前列腺特异的、受雄激素调节的TMPRSS2基因可与ETS家族成员(主要是ERG基因)发生融合,从而导致原癌基因ERG过表达,可能与前列腺癌的发生发展相关。ERG的免疫标记对于诊断前列腺癌具有较高的特异性,这一特点在转移性前列腺癌与前列腺小细胞癌的诊断中仍有很好的体现。然而,ERG免疫组化诊断前列腺癌的敏感性只有40%-50%,同时少部分高级别前列腺上皮内瘤变(HGPIN)也可表达ERG。ERG还可表达于血管源性肿瘤、脑膜瘤及少数原始神经外胚层肿瘤等。穿刺活检标本中的精囊腺/射精管上皮可出现局灶的核浓染和异型,偶尔这些非前列腺来源的正常组织可局灶表达PSA和AMACR, 易与前列腺癌混淆,此时PAX8有助于两者的区分,精囊腺/射精管上皮通常弥漫核表达PAX8而前列腺癌不表达。
在穿刺活检标本中,联合应用高分子量CK、p63及AMACR等可将大多数可疑为癌的非典型腺体病变与局限性前列腺癌区分开来。前列腺常用的基底细胞标志物为高分子量CK(34βE12或CK5/6)和p63。ISUP推荐使用AMACR/p63或AMACR/p63/34βE12鸡尾酒双染或三联免疫组织化学检测方法来明确小灶前列腺非典型腺体的性质。最新的研究发现p63的异构体—p40,是比p63更为特异的基底细胞标志物,但是由于p40在胞质也可着色,从而限制了其在鸡尾酒染色方法中的应用。但是需要注意的是,正常的前列腺腺体偶可局灶性表达AMACR,通常表现为腔面线状的弱颗粒状着色,而前列腺癌通常表现为胞质强而弥漫的颗粒状着色。此外,某些非肿瘤性的良性病变如非典型腺瘤样增生(AAH)以及肾源性腺瘤/化生可不同程度的表达AMACR,而在一些特殊类型的前列腺癌如泡沫样前列腺癌、增生性癌及萎缩性癌中,AMACR的表达可不同程度地减少甚至完全缺如,因此在实践应用中需要注意这些诊断误区,确诊还需结合直肠指诊、血清PSA水平、影像学检查所见以及常规形态学观察综合考虑。
前列腺导管内癌(IDC-P)是近年阐明的一种具有独特临床病理特征的前列腺癌实体病变。在前列腺穿刺活检标本中,鉴别孤立性的IDC-P与筛状HGPIN具有重要的临床意义,因为这两类病变在临床处理上具有明显的区别。IDC-P与HGPIN具有相似的免疫表型特征,应用常规的免疫组织化学染色对于鉴别两者意义不大,然而新近有研究显示,84%的IDC-P以及100%的筛状IDC-P存在人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)的胞质表达缺失,而所有的HGPIN均无PTEN的胞质表达缺失。
Gleason评分4或5的低分化前列腺癌需与高级别尿路上皮癌以及其他部位转移或浸润至前列腺的低分化腺癌区分,此时往往需要借助免疫组织化学染色。联合应用前列腺特异性标志物(PSA、 p501S或NKX3.1等)和GATA3(或高分子量CK、p63)可用于区分低分化前列腺癌与高级别尿路上皮癌。需要注意的是,高级别尿路上皮癌常见AMACR表达,而低分化前列腺癌可能出现AMACR表达缺失,因此AMACR对于区分两者帮助不大。前列腺特异性标志物(如PSA,P501s,NKX3.1等)和CDX2可用于鉴别低分化前列腺癌与转移性结直肠癌。前列腺原发性小细胞癌罕见,生物学行为呈高度侵袭性,诊断时需与高级别前列腺癌和其他部位累及或转移的小细胞癌鉴别,特别是膀胱原发性小细胞癌和转移性肺小细胞癌。正确区分前列腺小细胞癌与高级别前列腺癌能够指导临床采取不同的治疗方案。神经内分泌标志物(CD56、Syn和CgA)以及PSA在鉴别时意义不大。Williamson等研究显示,前列腺小细胞癌与普通型前列腺癌具有相同的克隆起源,同样具有TMPRSS2-ERG基因融合的分子遗传学特点。然而在前列腺小细胞癌中ERG免疫组织化学检测的敏感性不高,故仍推荐使用荧光原位杂交(FISH)方法检测TMPRSS2-ERG融合基因。需要注意的是,转录因子TTF1并非肺小细胞癌所特有的标志物,前列腺小细胞癌及其他部位小细胞癌均有一定的阳性表达率,因此不能依靠TTF1来判定小细胞癌的器官起源。此外广谱CK、高分子量CK、desmin、p63和CD34等可帮助鉴别诊断成人前列腺肉瘤(主要是间质肉瘤和平滑肌肉瘤)与肉瘤样癌,某些平滑肌肉瘤也可有广谱CK的表达,病理诊断时需注意该陷阱。
四、免疫组织化学染色在肾脏肿瘤诊断中的应用。
免疫组织化学染色在肾脏肿瘤中的应用主要体现在:(1)确定肿瘤的肾细胞起源以及(2)辅助肾脏肿瘤的分类。
PAX8和PAX2同属PAX基因家族,是肾细胞谱系重要的转录因子,在胚胎发育过程中对肾脏的器官形成发挥关键作用。PAX8是肾脏上皮性肿瘤最有用的标志物之一,除表达于正常肾脏上皮细胞以外,还表达于透明细胞性肾细胞癌、乳头状肾细胞癌、嫌色性肾细胞癌、MiTF/TFE易位相关性肾细胞癌、嗜酸细胞瘤等。与PAX2相比,PAX8的敏感性更高。但PAX8还可表达于女性生殖系统肿瘤、甲状腺肿瘤、胸腺瘤等,因此在判断原发灶不明转移性肿瘤的来源时,PAX8可与其他器官特异性标志物联用。其他肾源性标志物包括CD10、RCCm及Ksp-cadherin等,但其特异性不高,使用价值有限。
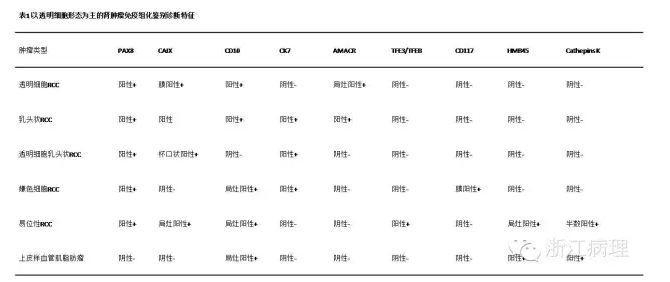
在临床工作中,大部分肾脏肿瘤可通过形态学特点进行组织学分类,然而当肿瘤分化较差或形态学特点存在重叠时,可借助免疫组织化学方法进行诊断和鉴别诊断。以透明细胞形态为主的肾肿瘤的鉴别诊断主要包括透明细胞性肾细胞癌、嫌色性肾细胞癌、透明细胞乳头状肾细胞癌、易位相关性肾细胞癌以及上皮样血管平滑肌脂肪瘤(E-AML)(表1)。碳酸酐酶IX(CAIX)是透明细胞性肾细胞癌和透明细胞乳头状肾细胞癌相对特异的标志物,两者不同的CAIX表达模式可用于鉴别诊断:前者表现为弥漫的膜表达,后者表现为胞质底部和两侧表达而腔面不表达的“杯口状”着色。此外,透明细胞性肾细胞癌不表达CK7或散在阳性,而透明细胞乳头状肾细胞癌CK7弥漫强阳性。联合应用CK7、CD117与CAIX可帮助鉴别诊断嫌色性肾细胞癌与透明细胞性肾细胞癌。MiTF/TFE易位相关性肾细胞癌特征性表达TFE3或TFEB及组织蛋白酶K(CathepsinK)而较少表达CK,此点可与透明细胞性肾细胞癌区分。E-AML特征性表达HMB-45、MART-1及Cathepsin K,而不表达肾细胞分化标志物PAX8。联合应用CAIX/CK7/AMACR可帮助鉴别诊断具有明显乳头状结构的透明细胞乳头状肾细胞癌与乳头状肾细胞癌, 前者表达CAIX与CK7,不表达AMACR;后者表达CK7及 AMACR,不表达CAIX。乳头状肾细胞癌伴有明显实性结构特征时需与后肾腺瘤及上皮细胞为主型肾母细胞瘤区分,三者均可表现为实性密集成片的小管状增生。CK7与AMACR联合CD57与WT1可帮助区分这三种形态学相似的肿瘤,乳头状肾细胞癌表现为CK7+/AMACR+/WT-1-/CD57-,而后肾腺瘤与肾母细胞瘤分别表现为CK7-/AMACR-/WT-1+/CD57+和CK7-/AMACR-/WT1+/CD57-。
嗜酸细胞型嫌色性肾细胞癌与嗜酸细胞瘤的鉴别诊断一直是泌尿病理日常工作中的重点和难点,CK7是目前鉴别两者最有用的标志物之一。经典型嫌色性肾细胞癌通常弥漫强阳性表达CK7,但嗜酸细胞型CK7表达可能差异较大,有时可仅出现局灶表达或失表达;嗜酸细胞瘤通常不表达或仅散在、斑驳状表达CK7。Ksp-cadherin是远端肾单位表达的一种细胞粘着糖蛋白,在嗜酸细胞瘤中主要表现为胞质着色,而在嫌色性肾细胞癌中则表现为胞膜和胞质的双重着色,但Ksp-cadherin在疾病诊断嫌色性肾细胞癌与嗜酸细胞腺瘤中的实际应用仍有待于进一步研究。
肾髓质癌与集合管癌均为远端肾单位起源的高级别肾细胞癌,前者可有特征性的临床表现(镰状细胞性血液病),但两者均可表现为实性、管状乳头状的生长方式,间质反应及炎细胞浸润等。肾髓质癌存在特征性的SMARCB1/INI-1基因表达缺失,可与集合管癌相鉴别。34βE12可在集合管癌有表达,在髓质癌不表达。最近有研究表明,干细胞转录因子OCT-4可高表达于肾髓质癌,该结果尚需进一步证实。联合应用PAX8和GATA3可用于鉴别诊断肉瘤样肾细胞癌与肉瘤样尿路上皮癌。尿路上皮癌通常不表达PAX8,但是少数上泌尿道发生的高级别尿路上皮癌可表达PAX8,特别是伴有腺样分化时可能造成与肾髓质癌或集合管癌的混淆,需引起病理医生的注意。
五、免疫组织化学染色在睾丸肿瘤诊断中的应用
免疫组织化学染色在睾丸肿瘤诊断和鉴别诊断中的应用主要体现在:(1)生殖细胞肿瘤的诊断和分类以及(2)生殖细胞肿瘤与其他非生殖细胞肿瘤的鉴别诊断(表2)。
大多数睾丸原发肿瘤都是生殖细胞来源的肿瘤,组织学分类包括精原细胞瘤(经典型和精母细胞型)、胚胎性癌、卵黄囊瘤、绒毛膜上皮癌等。不同类型的生殖细胞肿瘤具有不同的生物学行为和预后。SALL4是一种含锌指结构的转录因子,在维持胚胎干细胞多潜能分化和自我更新方面发挥重要作用。SALL4表达于几乎所有的精原细胞瘤、胚胎性癌和卵黄囊瘤,及半数以上的绒毛膜癌和畸胎瘤,是生殖细胞肿瘤区别于性索-间质肿瘤最重要的免疫组织化学标志物(后者SALL4为阴性)。OCT4是维持胚胎干细胞多潜能分化的重要核蛋白,根据其表达情况,可将睾丸生殖细胞肿瘤分为两组:曲细精管内生殖细胞肿瘤,未分类型(IGCNU)、精原细胞瘤和胚胎性癌(OCT4核阳性);卵黄囊瘤、精母细胞型精原细胞瘤和绒毛膜上皮癌(OCT4核阴性)。胚胎性癌在化疗后偶可出现OCT4反应活性的丢失。CD117和CD30是区分精原细胞瘤和胚胎性癌最重要的免疫标志物。CD117是表达于干细胞的酪氨酸激酶受体,主要表达于精原细胞瘤和IGCNU(95%-100%);几乎所有的胚胎性癌为阴性,卵黄囊瘤和精母细胞型精原细胞瘤可有不同程度的表达。Podoplanin(D2-40)和SOX17是与CD117诊断价值类似的备选标志物。D2-40 主要主要表达于IGCUN和精原细胞瘤的瘤细胞膜上,而将近30%的胚胎性癌可出现胞质顶端而非胞膜的D2-40表达,因此在实践应用过程中需要仔细观察染色的定位,避免误诊。CD30是肿瘤坏死因子受体家族中的一员,与CD117相反,其主要表达于胚胎性癌(93%-100%),而在其他精原细胞肿瘤中为阴性或散在阳性。AE1/AE3和SOX2是与CD30诊断价值类似的备选标志物。AE1/AE3普遍表达于非精原细胞的生殖细胞肿瘤中,主要为胞质着色,可作为与精原细胞瘤区分的诊断标志物之一。需要注意的是,而少数精原细胞瘤可出现非特异性的核旁逗点状而非胞质的角蛋白表达模式。Glypican3(GPC3)是一种膜性硫酸乙酰肝素糖蛋白,表达于100%的卵黄囊瘤和80%的绒毛膜上皮癌中,而在胚胎性癌和精原细胞瘤中(包括精母细胞型精原细胞瘤)罕有表达,可将卵黄囊瘤和绒毛膜上皮癌与其他肿瘤区分开来。AFP阳性是支持卵黄囊瘤又一有力的佐证。绒毛膜上皮癌还可表达hCG,但是内脏器官非生殖细胞肿瘤伴有滋养细胞分化时也可表达hCG,诊断时需注意。
大多数性索-间质肿瘤表达α-inhibin与calretinin,两者可与SALL4联合检测,用于性索-间质肿瘤与生殖细胞肿瘤的鉴别诊断。Sangoi等研究表明,类固醇生成因子1(SF-1)用于诊断性索-间质肿瘤的敏感性和特异性更高。联合SALL4、CD45、CD20和CD3可用于鉴别生殖细胞肿瘤特别是精原细胞瘤和胚胎性癌与大细胞淋巴瘤。部分淋巴母细胞性淋巴瘤、间变性大细胞淋巴瘤及髓样白血病偶可表达SALL4,此时可用广谱CK、OCT4或GPC3替代SALL4。睾丸转移性癌(高级别)的形态有时可与睾丸原发性生殖细胞肿瘤非常类似,联合SALL4、OCT4、EMA和CK7等可用于两者的鉴别诊断。需注意的是,某些尿路上皮癌、胃癌、卵巢高级别浆液性癌、肺小细胞癌等也可表达SALL4。

六、总结
泌尿生殖系统肿瘤类型较多,形态学复杂且有重叠,免疫组织化学染色在这些肿瘤的诊断和鉴别诊断中发挥了重要作用。作为外科病理诊断中的重要辅助手段之一,免疫组织化学标志物的选用及结果评判需紧密结合组织形态学特征和临床表现。因免疫组织化学标志物没有绝对的特异性,在临床实践中需联合使用若干个标记以达到明确诊断的目的。另外,还需注意不同标志物的细胞定位及表达模式不同,及其在应用中可能存在的诊断误区和陷阱。随着免疫组织化学技术的不断提高,越来越多的免疫标志物应用于泌尿生殖系统肿瘤的诊断和鉴别诊断,只有不断地学习,才能熟练应用各种免疫标志物,从而对疾病做出正确合理的诊断,避免误诊和漏诊的发生。
参考文献(略)
我要评论




共0条评论