我的博文
介绍国际泌尿病理协会2012肾肿瘤的专家共识
介绍国际泌尿病理协会2012肾肿瘤的专家共识 Introduction of International Society of Urological Pathology 2012 Consensus Conference on Renal Neoplasia
作者:1,赵明 2,滕晓东
《中华病理学杂志》2014年3月第3期
自从1981年第一版世界卫生组织(WHO)肾肿瘤分类问世以来,过去的三十年见证了肾肿瘤,特别是肾细胞癌在诊断术语命名,组织分类、分级以及肿瘤分期方面取得的一系列巨大的演进和进展。随着对肾细胞癌组织发生学和分子遗传学研究的不断深入,以及新的分子生物学技术和免疫标志物的不断涌现,许多新的肾肿瘤实体及其独特的临床病理特征得以被广泛的认识和描述。与之相对应的是,大量针对肾细胞癌临床预后的研究同时也揭示了许多具有评估肿瘤预后的病理参数;其中主要是肾细胞癌的病理分期以及不同组织学类型肾肿瘤的分级。正是基于此,国际泌尿病理协会(International Society of Urological Pathology, ISUP)于2012年3月在加拿大温哥华(Vancouver)召集了该机构的第四次共识会议,主要针对肾肿瘤四个方面的进展进行了广泛的问卷调查,分类讨论和共识达成,其中包括(1)成人肾肿瘤的分类;(2)肾细胞癌的组织学分级及其它预后因子;(3)肾细胞癌标本处理和分期以及(4)肾肿瘤的免疫组化诊断和分子预后标志物。本文的目的旨在简要的回顾这次会议针对肾肿瘤提出的一系列新进展和专家共识决定[1-5]。
一,成人肾肿瘤的分类
肾脏上皮性肿瘤的组织病理分类在过去的三十年中经历了多次的演进。通过整合大量的组织形态学,免疫组织化学以及分子和细胞遗传学表现而最终形成了2004年WHO泌尿生殖系统肿瘤病理学和遗传学的分类,该分类包括了将近50种肾肿瘤实体,其中肾细胞癌占将近1/4。近年来,随着对肾肿瘤组织发生学和分子遗传学研究的不断深入,许多新的肾肿瘤类型得以被不断的认识和描述。其中某些类型基于其独特的组织形态学,免疫表型和分子遗传学特征值得被称之为一个新的临床病理亚型,而另一些类型根据目前有限的研究和随访资料尚不足以划分为一个独立的实体亚型;而另外某些已知类型的肾肿瘤亚型,随着对其疾病发生及发展的深入认识,命名术语和分类范畴也在不断发生更替。根据会议前广泛的问卷调查和文献复习,共识会议对2004年WHO肾肿瘤的分类进行了更新,提出了一套新的分类方案,称之为ISUP温哥华肾肿瘤分类(International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)[2]。与2004年WHO肾肿瘤分类相比,新分类包括了5种新的肾细胞癌亚型,3种暂定的肾细胞癌亚型,并对某些已知类型肾肿瘤的命数术语和分类范畴进行了修正。
1,新的肾细胞癌亚型
5种新的肾细胞癌亚型包括(1)管状囊状肾细胞癌(Tubulocystic renal cell carcinoma);(2)获得性囊性肾疾病相关的肾细胞癌(Acquired cystic disease-associated renal cell carcinoma);(3)透明细胞(管状)乳头状肾细胞癌(Clear cell (tubulo)papillary renal cell carcinoma);(4)MiTF家族易位性肾细胞癌(MiTF family translocation renal cell carcinoma)包括Xp11易位性肾细胞癌和t(6;11)肾细胞癌;(5)遗传性平滑肌瘤病肾细胞癌综合征相关的肾细胞癌(Hereditary leiomyomatosis renal cell carcinoma syndrome-associatedrenal cell carcinoma)。
2,暂定的肾细胞癌亚型
3种暂定的肾细胞癌亚型包括(1)甲状腺滤泡样肾细胞癌(Thyroid-like follicular renal cell carcinoma);(2)间变性淋巴瘤激酶易位的肾细胞癌(ALK translocation renalcell carcinoma)以及(3)琥珀酸脱氢酶B缺陷相关的肾细胞癌(succinate dehydrogenase B deficiency associated renal cell carcinoma)。
3,对已经肾肿瘤类型的诊断术语和分类范畴的修订
(1)将多房囊性肾细胞癌重命名为低度恶性潜能多房囊性肾肿瘤(Mutilocular cystic renal cell neoplasm of low malignant potential),主要依据是按照WHO分类的严格标准诊断的绝大多数多房囊性肾细胞癌患者具有非常好的预后,在肿瘤完整切除的情况下几乎不会出现复发或转移,因此65%的与会专家一致认定将该肿瘤重新命名为低度恶性潜能多房囊性肾肿瘤;而大多数认为在该肿瘤中允许出现Fuhrman核分级2级的瘤细胞。
(2)乳头状细胞癌一般根据核级别分为I型和II型,嗜酸细胞乳头状肾细胞癌作为乳头状肾细胞癌的一个形态学亚型归为非特殊类型乳头状肾细胞癌范畴。
(3)杂合性嗜酸细胞/嫌色细胞肾肿瘤(Hybrid oncocytic/chromophobe renaltumor,HOCT)归入嫌色细胞肾细胞癌亚型。HOCT存在三个临床病理亚型即散发性的,与嗜酸细胞增生症/嗜酸细胞瘤病相关的以及与Birt-Hogg-Dube综合征相关的HOCT;尽管发生于不同的分子遗传学背景,但HOCT各亚型之间具有相似的形态学和免疫表型特征。HOCT与嗜酸细胞腺瘤和嫌色细胞肾细胞癌之间存在明显的组织学上的重叠,但是在分子表型方面与后两者存在明显的区别。大多数的HOCT临床表现为惰性肿瘤,到目前为止尚无肿瘤复发和转移的报道。尽管将近3/4的与会专家认为应该将HOCT归入嫌色细胞肾细胞癌范畴,但部分学者认为将其称为“恶性潜能未定的嗜酸细胞肿瘤(Oncocyticneoplasia of uncertain malignant potenial)”更合适。
(4)共识会议针对集合管癌的诊断达成了进一步的共识,需要满足以下诊断标准:病变至少部分累及肾髓质;明显的小管形成;存在促结缔组织增生的间质反应;高级别细胞学特征;浸润性生长;无伴随其它类型的肾细胞癌或尿路上皮癌。集合管癌与尿路上皮癌在形态学上鉴别诊断困难,而且也存在一些争议。尽管部分学者认为在集合管与尿路上皮汇合的区域,不同的肿瘤形态可能意味着肿瘤不同的分化方向,因此在典型的集合管癌背景下可允许出现少量的尿路上皮癌成分;但是达成共识的是如果肿瘤的95%以上为集合管癌形态,存在局灶的尿路上皮癌成分,应该诊断为尿路上皮癌伴明显的腺样分化。另外达成共识的是未分化肾细胞的背景中如果存在任何比例的集合管癌成分均应诊断为低分化集合管癌而不是未分类的癌。
(5)共识会议将具有上皮样形态学特征的血管平滑肌脂肪瘤进一步分为“上皮样血管平滑肌脂肪瘤伴非典型性”以及“上皮样血管平滑肌脂肪瘤,无非典型性”两类,提出的非典型性的形态学标准包括70%以上为非典型上皮样细胞,每10个高倍镜视野2个以上的核分裂像,存在非典型核分裂像,存在肿瘤性坏死;但同时也承认在进行有无非典型性区分时存在一定程度的主观性。关于上皮样血管平滑肌脂肪瘤的预后分级没有达成具体的共识;尽管将近64%的与会专家认为根据现有的标准应该将上皮样平滑肌脂肪瘤分为低危,中危和高危组,而不是简单的分为良性和恶性。
(6)囊性肾瘤与混合性上皮间质肿瘤是同一种疾病实体的两种不同的组织学类型,同属混合性间质上皮肿瘤范畴。支持这一分类的证据包括两者均明显好发于绝经前的中年女性,具有重叠的组织学,免疫表型特征以及相似的基因表达谱。
(7)肾脏滑膜肉瘤过去归入混合性间质上皮肿瘤范畴,但越来越多的证据表明滑膜肉瘤中的管状上皮性成分代表的是内陷的肾小管而非真正的肿瘤成分;因此共识会议将肾脏滑膜肉瘤划归为肾间叶性肿瘤范畴内。
二,肾细胞癌的分级系统以及其它预后参数
关于肾细胞癌的分级系统和预后病理参数,共识会议主要讨论了肾细胞癌的组织学表型,肉瘤样/横纹肌样分化,肿瘤坏死,分级以及微血管浸润作为肿瘤潜在的预后因子的作用[3]。
1,肿瘤组织学表型的共识决定
肾细胞癌的主要组织形态学表型具有明显的预后意义。乳头状肾细胞癌根据核仁大小分为I型和II型具有预后意义。透明细胞乳头状肾细胞癌相对于透明细胞肾细胞癌以及乳头状肾细胞癌来说具有明显较好的临床结局。而对于管状囊状肾细胞癌的预后则基于有限的随访资料未能达成共识。同样的原因,对于MiTF家族易位性肾细胞癌不同的基因表型是否具有不同的预后意义也未能达成共识。
2,肉瘤样分化的共识决定
会议广泛讨论了肾细胞癌肉瘤样分化的定义和组织学诊断标准,但是没有达成共识。提出的诊断肉瘤样分化的形态学特征包括长梭形的非典型肉瘤样细胞,无梭形细胞形态的非典型肉瘤样细胞;少数与会者认为只要存在梭形细胞或伸展的上皮样细胞即考虑存在肉瘤样分化。文献报道肉瘤样分化的区域占肿瘤的比例从1%到100%不等;大多数的与会专家认为诊断肉瘤样肿瘤无最低比例限制,即只要存在肉瘤样分化就需要在报告中指出;但是会议并没有正式讨论是否需要在报告中指出肉瘤样癌所占的比例。肉瘤样肾细胞癌可起源于各种不同组织学类型的肾细胞癌,其中集合管癌发生肉瘤样分化的几率最高(25%-29%)。尽管肉瘤样肾细胞癌中癌性成分的组织学类型对肿瘤的预后似乎并无太大影响,但是某些转移性的肿瘤中可能仅含有癌性或肉瘤样成分,在这种情况下报告癌性成分的组织学类型可有助于确认原发肿瘤的部位。另外,对于伴有透明细胞肾细胞癌的肉瘤样癌和非透明细胞肾细胞成分的肉瘤样癌,治疗方式可能不同,主要是对受体酪氨酸激酶抑制剂治疗的反应的不同。因此,共识会议推荐在诊断肉瘤样癌时需要报告癌性成分的组织学类型。最后,对于纯肉瘤样癌,大多数与会专家一致认为将其报告为4级未分类肾细胞癌伴肉瘤样分化。
3,横纹肌样分化的共识决定
肾细胞癌横纹肌样分化指的是肿瘤细胞形态上类似于横纹肌母细胞,但是具有不同的超微结构和免疫表型特征。组织学上表现为大的,黏附性差的上皮样肿瘤细胞,伴有大的胞浆内嗜酸性包涵体以及偏位的不规则的核以及明显的核仁。共识会议指出需要在报告中指出是否存在横纹肌样分化,与之相关的肾细胞癌的组织学亚型,而无需报告横纹肌样分化区域所占的比例。
4,肿瘤坏死的共识决定
将近30%的肾细胞癌可出现不同程度的肿瘤性坏死,可表现为从肉眼可见的大片坏死到仅到显微镜下可见的小灶坏死。大量的证据表明,存在肿瘤性坏死与透明细胞肾细胞癌的预后不佳有关;但并不是所有类型的肾细胞癌均是如此;如乳头状肾细胞癌,肿瘤常常可发生自发性的退行性坏死。共识会议推荐在透明细胞肾细胞癌的常规报告中需要指出是否存在肿瘤性坏死;而且需要评估包括肉眼可见的和显微镜下可见在内的肿瘤性坏死。另外,需要指出坏死成分的比例。
5,肿瘤分级的共识决定
肾细胞癌的存在多个分级系统,实践诊断中应用最广泛的是Fuhrman分级系统。但是使用这一分级系统存在许多问题。首先核仁明显程度的评估相对比较主观;对于核多形性的定义并不明确;最后,核直径大小,核仁明显程度,核多形性多个参数之间并没有明确到底哪一参数在分级肾细胞癌占据主导地位。在实践过程中许多病理医生仅仅使用核仁明显程度这一参数来对肾细胞癌进行分级,而事实上却违背了Fuhrman分级系统的最初标准。此外,越来越多的证据表明Fuhrman分级系统对于许多非透明细胞肾细胞癌并不适用,不能很好的反应肿瘤分级与预后之间的关系;如嫌色细胞肾细胞癌。基于此,共识会议提出了一套新的分级标准称为ISUP分级系统。该系统依据瘤细胞的形态以及在不同倍数视野下的核仁大小和明显程度将肿瘤分为4级。ISUP1级:400倍下瘤细胞无核仁或核仁不明显;ISUP2级:400倍下瘤细胞可见清晰的核仁,但在100倍下核仁不明显或不清晰。ISUP3级:100倍下可见清晰的核仁。ISUP4级:瘤细胞显示肉瘤样或横纹肌样分化;或者含有瘤巨细胞;或者显示明显多形性的核伴有成簇的染色质。这一分级系统适用于透明细胞肾细胞癌和乳头状肾细胞癌。大多数的与会者认为目前不需要对嫌色细胞肾细胞癌进行分级。
6,微血管浸润的共识决定
肾细胞癌是具有高度血管化间质的肿瘤,因此脉管内肿瘤浸润相对比较常见。肾细胞癌微血管浸润(Microvascular invasion, MVI)发生比例从5.6%到18%不等。证据表明,MVI与肾细胞癌的肿瘤大小,分级,分期,淋巴结和远处转移状态,以及患者的疾病相关存活率存在一定的关系,可能是提示肿瘤预后不佳的潜在预测因子。根据会议前的问卷调查,大多数的调查参与者将肿瘤细胞位于小血管内,位于邻近肿瘤的肾实质内,位于肿瘤假包膜内定义为MVI,并将其认定为肿瘤的一个潜在的预后参数。但是共识讨论认为现有的证据还不足以证实MVI是肾细胞癌的预后因子,无需在病理报告中强制性的指出是否存在MVI;同时共识会议认定MVI不应整合入肾细胞癌现有的TNM分期之中。
三,肾细胞癌的标本处理和分期
分期是决定肾细胞癌患者临床结局最重要的预后因子;分期取决于肿瘤大小,是否存在邻近结构的浸润,是否存在静脉内癌栓以及淋巴结和远处转移的状态。正确的处理肾肿瘤切除标本是对肿瘤进行准确分期的基础。2010年肿瘤淋巴结转移(TNM)分期系统对肾细胞癌的分期作了较大的改动和修正,其中的一些变化需要体现在我们的常规病理诊断实践中。ISUP肾肿瘤分类共识会议对肾细胞癌的标本处理和分期评估中遇到的一些问题达成了一系列的共识决定,主要是针对与患者临床处理和预后密切相关的一些问题[4]。
1,标本的切开和处理
肾脏切除标本主要是根治切除标本和部分肾切除标本,在标本切开和取材之前需要足够的固定并用墨汁对切缘进行标记,标记切缘主要有两种方法,一是选择性标记即仅标记可疑存在肿瘤累及的切缘,另外就是将整个标本的外表面全部标记。对部分肾切除标本进行选择性标记时需要标记肾实质切缘,如果标本含有一部分肾周脂肪也需要标记。对于肾脏根治切除标本,沿着标本的长轴在肾门(集合系统)处通过静脉系统将标本剖开,充分暴露肿瘤与肾窦之间的关系,观察肿瘤与肾盂,肾窦脂肪和血管系统的关系。
2,肿瘤的测量
根据2010年的TNM分期系统,准确的测量肿瘤的最大直径具有重要的预后意义。测量肿瘤直径之前,需要对肿瘤进行连续的切开,仔细的寻找肿瘤最大面并记录最大直径。共识会议指出测量肿瘤大小时除了包括主肿瘤的大小外,如果存在的话,还需要包括肾被膜外和肾窦扩散的肿瘤部分,而肾静脉或腔静脉癌栓的大小无需测量也无需包括在肿瘤的大小之内。小的卫星肿瘤灶也不包括在评估主肿瘤大小的范围内。
3,肿瘤取材的数目
肾肿瘤的取材需要对肿瘤与邻近结构(如肾周脂肪,肾窦,肾静脉,邻近肾实质)的交界面和大体上显示不同颜色特征的区域进行取材。对于取材数目的问题,共识讨论达成一致的基本方针是每1cm的肿瘤至少取1个组织块,每个肿瘤至少3个组织块(具体情况可视不同的病例而不同)。当存在多个肿瘤时,共识会议推荐至少需要对5个最大的肿瘤进行测量和取材,若存在5个以上的肿瘤,可以只对5个直径最大的肿瘤进行取材。当然这并不是绝对的限制,当任何肿瘤出现不同的大体特征和表现时,均应进行额外的取材。
4,肾周脂肪浸润的评估
肾周脂肪位于肾被膜外,Gerota筋膜内。肾周脂肪的数量依切除标本的不同而各异,肾上腺常常位于肾上极内侧面的肾周脂肪内。肾细胞癌由于膨胀性生长常常造成肾轮廓的变形并对肾周脂肪组织形成挤压之势。但是如果肿瘤周围存在界限清楚的推挤状边界的话,即使瘤体越过肾皮质到达肾周脂肪内也不足以诊断为肾周脂肪的浸润。大体上识别肾周脂肪浸润的特征包括肿瘤轮廓不规则,与脂肪组织边界不清,或者脂肪内出现多灶性的不规则肿瘤结节。大多数的与会专家认为大体上评估肾周脂肪浸润的最佳办法是对肿瘤与肾周脂肪的垂直交界面进行多切面检查,如果存在浸润的话,该区域应该广泛取材并在显微镜下证实。而显微镜下诊断肾周脂肪浸润的共识决定则是肿瘤或者直接与脂肪接触,或者通过不规则的舌状结构扩散入脂肪内,可伴或不伴有促纤维增生性的间质反应。
5,评估肾窦浸润
肾窦脂肪是肾周脂肪组织的中央部分,位于肾盂肾盏系统与肾实质之间,其内含有丰富的淋巴血管系统。肾窦脂肪浸润是肾细胞癌常见的肾外扩散方式之一。如果仔细取材的话,超过90%的直径大于7cm的透明细胞肾细胞癌存在肾窦脂肪的浸润。尽管在过去的二十年中,人们逐渐认识到评估肾窦脂肪浸润对肾细胞分期的重要性,但是对于取材方法和数量并没有一致的定论。在共识会议上,几乎所有的与会专家均认为如果大体检查无法明确是否存在肾窦脂肪浸润,那么至少需要在肿瘤与肾窦交界处取3个组织块评估;如果大体检查存在明显的肾窦侵犯,或者小的部分肾切除标本明显没有肾窦的侵犯,那么只需对肿瘤与肾窦交界面取1个组织块来证实或排除即可。肾窦浸润的组织学诊断标准也达成了共识即肿瘤细胞直接接触肾窦脂肪,或者肿瘤位于肾实质外的疏松结缔组织内。此外,肿瘤累及肾窦内具有内皮细胞衬里的腔隙时,不管其直径大小也被大多数的与会专家认为是肾窦的浸润。总之,肿瘤累及肾窦内的任何组织结构(包括脂肪,疏松结缔组织,以及内皮细胞衬里的腔隙)均被认为存在肾窦的累犯。共识会议没有解决肿瘤直接浸润至肾盂伴或不伴肾窦的累犯的分期问题。
6,肾静脉取材,肾静脉切缘阳性,腔静脉浸润
2010年TNM分期系统定义肾静脉浸润(pT3)为大体上肿瘤直接浸润至肾静脉及其分支。尽管大体检查肾静脉及其分支是处理肾脏根治切除标本的一个重要组成部分,但是并不可能检查到肾静脉所有的分支部分。而且在肾窦处切片取材时,在大体检查无明显肿瘤浸润的情况下,常常可发现显微镜下的肾静脉癌栓,大多数的专家认为存在这一情况足以将该肿瘤诊断为pT3a期。当肿瘤直接接触血管壁或填充并扩张血管腔时即为血管内的浸润,可发生于主肾静脉及其大的分支部分。另外一个问题是,肾肿瘤标本切除和固定后,血管往往出现收缩,此时血管断端如果出现癌栓如何确定是真正的切缘阳性还是血管收缩后引起的假象?共识讨论对于肾静脉的取材方法基本达成了共识,大多数的问卷调查者对血管切缘取材,如果大体上怀疑有静脉壁癌栓黏附的话,再对瘤栓进行切片取材;只有真正的血管切缘上存在瘤细胞黏附并在显微镜下证实才考虑为肾静脉切缘阳性。腔静脉肿瘤浸润为pT3c期肿瘤,定义为大体上肿瘤扩散入横膈以上的腔静脉或浸润至腔静脉壁内。如果送检标本仅指明为“腔静脉癌栓”,病理医生需要证实其内是否含有肿瘤成分,并且确定有无腔静脉壁的肌组织,因为一个横膈以下的腔静脉癌栓如果证实存在静脉壁浸润的话,可将肿瘤由pT3b分期上升至pT3c分期。共识会议推荐至少需要2个以上的切片来检查腔静脉壁组织和可能的浸润。
7,未受累肾实质的取材
大多数的专家认为需要对非肿瘤性肾实质取材,包括邻近肿瘤的肾实质以及远离肿瘤的肾实质,主要目的在于评估是否伴存有非肿瘤性的肾疾病包括肾小球疾病,肾小管间质性疾病以及血管性疾病等。
8,肾上腺累及
肾肿瘤直接浸润至肾上腺在2010年的TNM分期中被分类为pT4期肿瘤,与2002年TNM分类中的pT3a分期相比发生了明显的变化。主要归因于一个事实即肿瘤累及肾上腺与肾周脂肪相比预后明显更差。当肾上腺被肿瘤累及的时候,一个重要的问题是区别直接浸润(pT4)还是血源性转移(M1),主要取决于肿瘤的大体表现和显微镜下评估,血源性转移常见脉管内癌栓。
四,肾肿瘤诊断和预后的生物标志物
随着分子诊断技术和药物靶向治疗在肾肿瘤诊断和治疗领域的不断推广和进展,生物标志物在肾细胞癌的疾病组织发生,病理诊断和分类,预后评估以及靶向治疗选择各方面得以不断的应用。共识会议主要讨论了生物标志物在肾肿瘤免疫组化诊断和预后方面的应用和进展[5]。
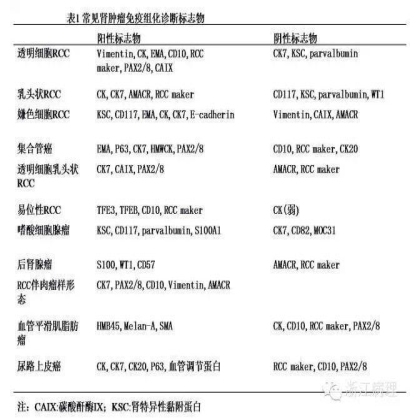
全面的取材和仔细的组织学观察可以对大多数的肾肿瘤进行准确的诊断和分型,免疫组化染色主要用于罕见类型肾肿瘤的分型,上皮性肿瘤与非上皮性肿瘤,原发性肾肿瘤与罕见的转移性肿瘤的鉴别诊断。在会议前的问卷调查中,半数以上的调查者在组织学亚分类肾肿瘤时使用免疫组化染色,少数学者仅在穿刺活检中的肾肿瘤中应用,另外一些人则在鉴别原发性与转移性肾肿瘤时使用。大多数的专家在诊断未分类的肾细胞癌之前,都会使用免疫组化染色以排除其它已知类型肾细胞癌的可能。关于免疫组化染色在实践诊断中的应用几率,绝大多数调查强调在诊断需要的情况下,“有时”或“偶尔”使用免疫组化染色,而将近13%的专家“很少”或“几乎不”使用免疫组化染色。常见用于肾肿瘤诊断和分型的标志物包括角蛋白(CK),波纹蛋白(vimentin),上皮膜抗原(EMA),甲基消旋酶(AMACR),碳酸酐酶IX(CAIX),PAX2,PAX8, 肾细胞癌标志物(RCC maker),CD10,E-cadherin, 肾特异性黏附蛋白(KSC),微清蛋白(parvalbumin),紧密连接蛋白7(claudin-7),紧密连接蛋白8(claudin-8),S100A1,CD82,CD117,TFE3,TFEB,血栓调节蛋白(thrombomodulin),P63以及S100P等,有时往往需要联合使用一系列的免疫标志物(表1)[5]。在会议前的问卷调查中,最常应用于肾细胞癌诊断和鉴别诊断的标志物是CK7,其次是CD10。在鉴别诊断原发性肾肿瘤与转移性肿瘤时,PAX2和PAX8则被共识专家认定是证实肾肿瘤起源最好的标志物。但在一个转移性肿瘤可能是肾来源的情况下,使用何种免疫组化标志物来予以证实和排除并没有达成共识;提出的可使用的标志物包括PAX2,PAX8,RCC maker, CK, CK7,CD10等,但需要结合形态学背景再辅以其它部位特定的标志物综合判断。会议还讨论了透明细胞肾细胞癌与嫌色细胞肾细胞癌,嗜酸性嫌色细胞肾细胞癌与嗜酸细胞腺瘤的免疫组化鉴别诊断问题,但并没有达成一致的专家共识。
关于肾细胞癌中分子诊断和预后标志物的应用,会议前的问卷调查显示大多数的病理医并不在常规实践中应用分子遗传学研究和生物标志物来评估肿瘤的预后,而临床医生通常也没有类似的要求。对于肾肿瘤的分子诊断,问卷调查表明荧光原位杂交(FISH)是目前最常应用的研究手段,VHL基因突变和杂合性缺失分析则较少应用;而达成共识的是,当诊断一个30岁以下的肾细胞癌或者肿瘤的组织形态学特征强烈提示易位性肾细胞癌时,病理医生需要进行TFE3和TFEB的免疫组化染色或FISH分析。
参考文献(略)
我要评论




共0条评论