我的博文
通路 | Hippo信号通路活性影响肝细胞命运
摘要:
Hippo信号通路是细胞增殖和器官大小的重要调节器。然而,鲜为人知的是,这一级联反应对于细胞结局的调节作用。作者运用了谱系追踪,克隆分析和组织化培养方法证明了,Hippo信号通路的活性对于维持肝细胞的分化是至关重要的。值得注意的是,体内Hippo通路的急性失活可导致非常高的去分化率。这意味着这些细胞反转时钟重新变回了干细胞样状态,因此使得它们能够生成一些可再生病变肝脏的功能性祖细胞。这对肝脏再生的认识和操作意义的一个前所未有的高度。
背景介绍:
数十年来肝脏都是一种再生模型,众所周知成熟肝细胞可以响应损伤进行复制。即便手术切除四分之三的肝脏,仅凭细胞复制就可以让器官恢复正常的功能大小。这些新研究表明,有第二种再生模式或许可以修复非急剧性的,更为持久的肝损伤,并挑战了长期以来的理论:肝脏中存在一个有待激活的干细胞池。
作者通过这项研究阐明了成熟肝细胞巨大的可塑性。并不是只有非常小的一个细胞群可以招募至损伤处;几乎80%的肝细胞可以经历这种细胞命运转变,且证明了Hippo/YAP信号通路是肝脏大小的关键调节剂。
论文解析
YAP在胆总管中富集和激活
Hippo的相应细胞在肝脏内的特性还不清楚,为了深入研究,作者在哺乳动物的肝脏上皮细胞中分析Hippo途径的信号活动。YAP在胆管中呈现高水平表达,而在肝细胞中则是较低的水平,并且其信号弥漫在整个细胞中。免疫组化分析也证实了这点,免疫印迹分析中纯化导管细胞中的YAP蛋白水平更高。如下图:
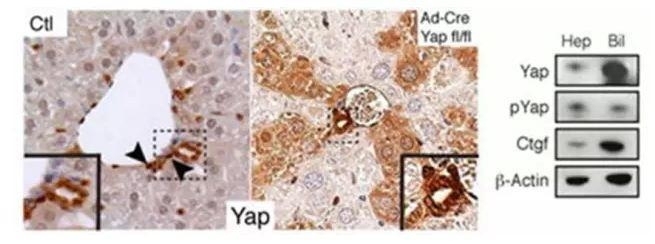
为了更进一步的观察,作者对小鼠的结缔组织生
因此,作者认为YAP活性和表达被高度富集在与祖细胞相关标记物的导管细胞中。另一方面,成熟肝细胞表现出更高的Hippo通道活性和YAP核水平和转录降低。
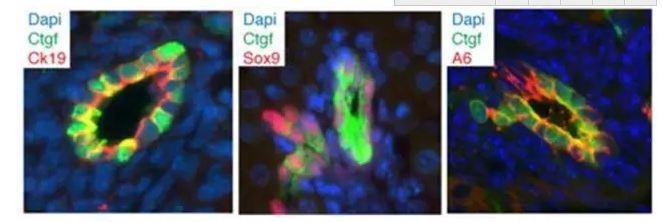
YAP的激活能去分化单个成人肝细胞
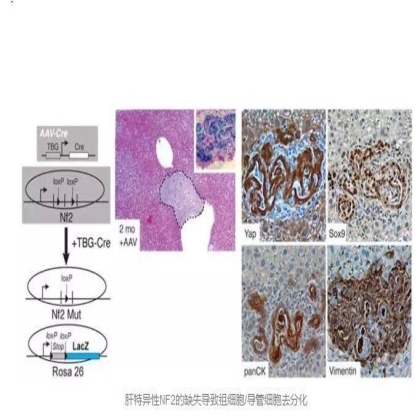
接下来,要探究改变内源性肝细胞的Hippo通路是否会导致肝细胞去分化。NF2是一种已知能负向调节YAP的蛋白,而且,NF2的消融发生在所有肝细胞类型导致的肝癌和胆管癌中。因此作者推测,肝细胞特异性NF2的损失会导致肝过度生长并使肝细胞去分化成胆管细胞和组细胞。在对Nf2fl/fl老鼠给药AAV-Cre两个月后,观察到祖细胞和导管细胞的YAP,SOX9和panCK在Nf2突变的肝脏中染色明显。这些数据说明改变内源性Hippo通路的信号可以重新使肝细胞重新成为导管细胞且有肝祖细胞的特性。
长因子基因进行荧光染色发现,EGFP表达不存在于肝细胞,而是被限制在胆管细胞导管细胞的与祖细胞相关标记物中。
YAP表达激活肝祖细胞程序
要了解YAP介导去分化的分子基础,并且观察YAP Tg细胞的分子特性,对多个时间点的EYFP+细胞在Dox诱导和FACS提纯后进行微阵列分析。观察到了肝细胞表型的广泛渐进沉默,并且逐步获取与胚胎肝脏发育已经导管/祖细胞有关的基因。再通过基因富集分析证明内源性肝祖细胞与YAP转基因细胞密切相关。分析还显示限制重编程的过程包括NOTCH,TGFβ与EGFR信号的关联。这些数据说明,在肝细胞中YAP表达停止了肝细胞特异性基因的表达,并导致类似于内源性肝祖细胞分子的特定富集。
Hippo途径信号的再引入诱导肝细胞重新编程分化
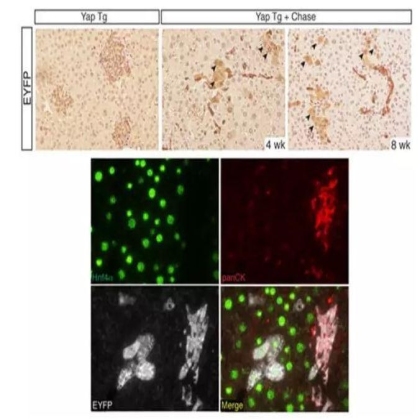
上述实验的结果表明YAP在肝细胞中活化会去分化肝细胞成为一种在形态,表型和分子构成上都与肝祖细胞相似的细胞。同时也提出了一个可能,减少在肝祖细胞的YAP水平可以使其分化。
在给药Dox4周后观察,98%以上的EYFP+细胞是典型导管型的panCK+,停药后4周和8周再次观察,EYFP+细胞仍然可以在整个肝实质被观察到。因此当正常的Hippo通路在体内被重新构建后,肝细胞衍生的祖细胞可以重新分化成肝细胞。
在重编程过程中YAP的NOTCH下游信号
NOTCH信号途径是已知的胚胎发育过程中胆细胞生长的重要因素,对HES1进行免疫染色证实了在YAP表达的肝细胞中NOTCH信号通路被激活。接下来的调查是否有些NOTCH基因是YAP / TEAD的直接转录目标,实验证实了在人类胆管癌细胞中去除YAP/TAZ导致了Notch2的mRNA减少了50-75%。因此,研究人员认为YAP/ TEAD直接调节Notch2和其他NOTCH通路基因的转录以影响NOTCH信号。
综合上述所有,证明了Hippo/YAP起了NOTCH信号的上游作用,其活性对肝细胞的去分化非常重要。
思路总结
在这项研究中研究人员利用出生即患一种遗传性肝病的小鼠,探讨了是否有可能通过控制Hippo信号在实验皿中培育出无数的肝祖细胞。他们培育了健康肝祖细胞,将它们移植到患病小鼠体内。在3-4个月的时间内,移植肝细胞被灌注到小鼠体内,它们的疾病有所好转。
自90年代初期以来,人们一直在设法利用肝细胞移植物来治疗某些代谢疾病,然而由于细胞的来源是被丢弃的肝脏,他们未取得成功。有了来自患者的这种无限的细胞资源,我们认为或许是时候重新思考是否应该在肝遗传性疾病情况下进行肝细胞或祖细胞移植。在观察到成熟肝细胞去分化之前,在其他的研究人员发布了许多相关研究中,在不同内脏,包括肾脏、肾上腺和肺脏中的一些成熟细胞比原以为的更具可塑性。本文是肝细胞再生方面的另一种思路,但是由于这一领域一直以干细胞为中心,从而忽视了其他的东西。这次研究人员让我们了解到机体中的细胞具有可塑性,作为这种可塑性基础的信号通路,有可能为操控再生或是扩增用于再生医学的某些细胞类型提供另一种途径。
参考文献:Dean Yimlamai, Constantina Christodoulou, Giorgio G. Galli, Kilangsungla Yanger, Brian Pepe-Mooney, Basanta Gurung, Kriti Shrestha,Patrick Cahan, Ben Z. Stanger, Fernando D. Camargo. DOI: 10.1016/j.cell.2014.03.060
我要评论




共0条评论