我的博文
通路 | 研究套路分解:MAPK pathway与肿瘤发生
近二十年来,世界范围内最吸金的研究方向当属细胞信号通路与肿瘤之间的恩恩怨怨。丝裂原活化蛋白激酶MAPK信号途径是细胞中大佬级别的信息传递链,由细胞内广泛表达的Ser/Thr蛋白激酶,参与细胞的生长、发育、分化、凋亡等一系列细胞生理活动,是诱发肿瘤产生的重灾区。目前,虽然研究MAPK信号传导与肿瘤之间关系取得了不错的进展,但要完全揭示其机制,还需要更加深入的研究。
已知的MAPK信号通路有四类,今天我们主要介绍其中Ras/Raf/MEK/ERK途径与肿瘤千丝万缕的关系。熟悉信号通路的童鞋们肯定知道Ras、Raf、MEK和ERK蛋白就是该通路中的关键因子,其中任何一个蛋白的功能异常都会导致严重的肿瘤疾病。
一张图记住Ras/Raf/MEK/ERK信号转导途径:
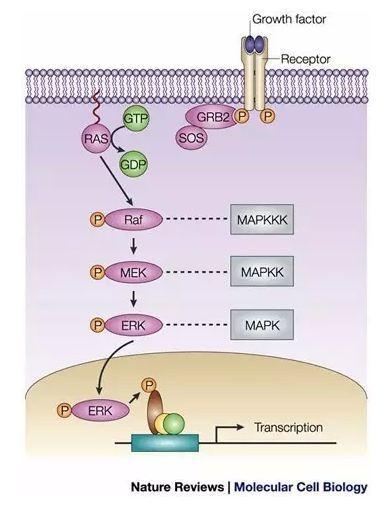
RAS蛋白就是我们平时常说的小G蛋白,当它结合GTP后具有磷酸化活性,行使下游蛋白的激活功能。RAS是多种细胞信号转导途径中的关键组分,它的活性状态对细胞的生长和分化具有重要影响。目前,在人类的癌症发生过程中,主要有KRAS、HRAS和NRAS这三类RAS蛋白。突变导致的RAS蛋白永久性激活在所有人类癌症中占据非常高的比例,故针对RAS的抑制剂是治疗癌症的有效药物。
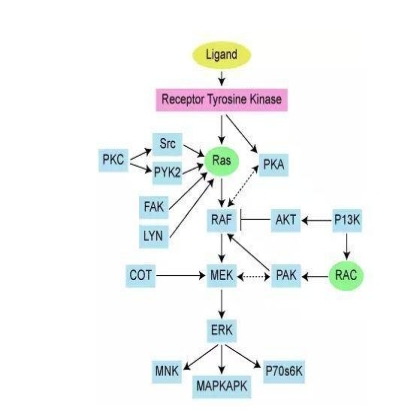
RAS蛋白参与多种细胞信号转导途径:
回顾2015年国自然评审结果,涉及关键癌基因的相关内容约有41项之多。其中不乏时下非常热门的原癌基因和抑癌基因,如YY1、FBW7、CD177和PPEF2等。接下来,我们以FBW7基因在胰腺癌中的研究成果,对“信号通路——癌基因”的研究思路有大致的了解。
FBW7基因编码的蛋白是SCF型泛素连接酶中介导底物识别的部分,常参与底物的泛素化,引导底物被蛋白酶体降解。FBW7可介导包括原癌蛋白在内的许多重要蛋白的泛素化,如cyclin E、Notch、mTOR、c-Jun和c-Myc等众多在细胞周期、细胞增殖及分化过程中发挥重要作用的蛋白质。因此FBW7的失活会引起多种恶性肿瘤的发生,如胃癌、结肠癌、乳腺癌、肝癌等。
2015年上海肿瘤医院的虞先濬教授在Cell Research上发表FBW7与胰腺导管腺癌(PDAC)相关的研究性论文。其科研团队发现磷酸激酶ERK能够对FBW7进行磷酸化促进其降解,这一过程影响了FBW7发挥其肿瘤抑制因子功能,诱导胰腺癌发生。
胰腺导管腺癌(PDAC)是胰腺癌中常见的一种可怕疾病,其5年生存率不到5%,是所有癌症中致死率最高的一种。由于缺少有效的早期检测方法以及该种癌症初次诊断后的高转移率,只有15%~20%的病人能够进行切除手术。因此,提高临床治疗的实践性迫在眉睫,同时需要对PDAC发生发展的分子机制有更深入的了解。
根据早期的研究我们知道FBW7与Ras/Raf/MEK/ERK信号通路存在密切的关系,但是并不清楚FBW7的表达水平是如何受到调控的。在本研究中,科学家首先在胰腺癌临床样本中发现FBW7低表达与ERK激活显著相关,ERK激活主要是由于胰腺癌中KRAS突变导致的。通过进一步研究发现ERK能够直接磷酸化FBW7的205位苏氨酸,促进其发生自身泛素化降解。研究人员随后证实FBW7的T205A突变体能抵抗ERK的磷酸化,并导致其中一个重要的原癌基因c-Myc表达水平下降,结果发现胰腺癌细胞增殖及肿瘤发生过程均受到显著抑制。总的来说这些结果揭示了癌基因KRAS突变是如何通过抑制肿瘤抑制因子FBW7促进胰腺癌进展,对于胰腺癌临床实践治疗提供了良好的分子基础。
MAPK信号通路与FBW7相互调节示意图:
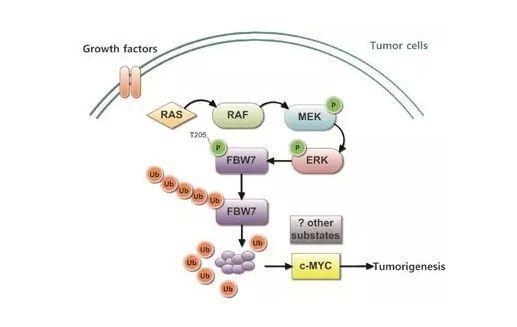
该文是如何确定FBW7的磷酸化位点及ERK对FBW7的磷酸化作用?作者根据最新的研究,确认Thr205-Pro206是FBW7上唯一的潜在磷酸化位点,然后通过两方面来确定Thr205是否为确切的激活位点:1)FBW7蛋白上的Thr205与特异性抗体结合后,显著降低FBW7的磷酸化水平;2)构建FBW7的T205A突变体,发现其难以被磷酸化。后续实验中,作者过表达持续磷酸化的ERK蛋白,并检测到FBW7的磷酸化水平升高而FBW7-T205A的磷酸化水平降低。
用最精炼的方式介绍MAPK 信号转导方式:胞外信号→膜受体→RAS→MAP3K→MAP2K→MAPK然后再进一步活化其他下游靶基因。上文提到,MAPK主要由四个亚家族,分别是:
细胞外信号调节激酶(extracellular-signalregulated protein kinase, ERK)
p38丝裂原活化蛋白激酶(p38 MAPK)
c-Jun氨基末端激酶(JNK)
细胞外信号调节激酶5(ERK5)
这几种MAPK亚家族参与的信号转导通路司职不同的功能,如ERK调控细胞生长和分化,JNK和p38 MAPK信号通路在炎症和细胞凋亡等应激反应中发挥重要作用。
参考文献:
1.Ji, S., et al., ERK kinase phosphorylates and destabilizesthe tumor suppressor FBW7 in pancreatic cancer. Cell Res, 2015. 25(5): p. 561-573.
我要评论




共0条评论