我的博文
EGFR FISH的预测能力与突变相当——中山大学肿瘤医院数据引起的思考
首先声明,本文摘录了最近三年的一些针对非小细胞肺癌(NSCLC)中EGFR状态(基因扩增和基因突变)究竟哪个更合适作为临床标志物检测的综述观点,特别是2013年中山大学肿瘤医院邵建永等人发表的数据,以期抛砖引玉,供大家参考。
EGFR作为被研究得最为透彻的驱动基因,在NSCLC中有约三十年的药物开发历史,是最为重要的个体化医疗里程碑。针对EGFR基因有两类药物,针对胞外区的单克隆抗体药物(西妥昔单抗,帕尼单抗)和针对胞内酪氨酸激酶结构域的TKI药物(吉非替尼,厄洛替尼)。在临床药物应用的过程中,一个核心问题就是以EGFR基因的哪种状态(蛋白表达?基因扩增?基因突变?)进行检测更为有效,分别对应的主要方法为IHC、FISH、ARMS-PCR或测序等。以检测EGFR基因扩增的临床研究开展得较早,数据较多,但主要集中在白种人。而自20 04年发现EGFR基因突变以来,一些大型临床研究结果显示基因突变对TKI药物使用更为敏感和有效,且于2011年写进NCCN指南,基因突变检测的主导地位得以确立。
但是,目前学术上针对EGFR检测究竟用扩增还是突变仍存在争议,特别是人种差异(白种人 vs 黄种人)这一因素。国内以吴一龙教授为首也发表了很多权威数据(如OPTIMAL,IPASS),但整体上国内数据偏少。国内目前很多医院都开展了EGFR突变检测,那么,国内EGFR突变与扩增的关系如何?EGFR FISH检测基因扩增有无必要?如何进行?这里重点介绍2013年中山大学肿瘤医院邵建永等的数据,以及2011年发表的三篇综述,供大家参考和思考。
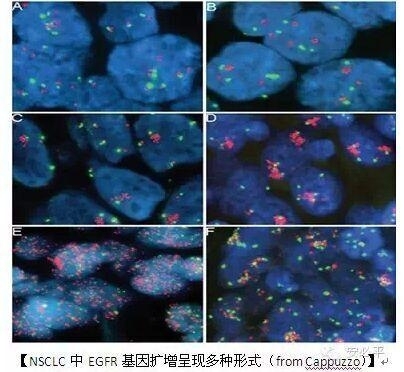
一:中山大学肿瘤医院邵建永等的研究数据
2013年,邵建永等在Journalof Translational Medicine杂志上发表了研究目的为在伴有EGFR基因高拷贝(扩增)的晚期NSCLC病人中能否从TKI治疗中获益的文章。所用样本为2004年至2011年在中山大学肿瘤医院、中山大学第一附属医院和广州军区总医院的502位经TKI治疗的NSCLC患者,分别进行了EGFR基因扩增(FISH)和突变检测,随后分析了这两种检测结果在TKI治疗中获益的关系。
结果显示,EGFR FISH阳性和突变阳性患者都意味着更高的用药反应率(分别为37.2%和43.7%),更佳的无疾病进展生存期PFS(FISH阳性11.2个月,突变阳性11.7个月)和总生存期OS(FISH阳性30.2个月,突变阳性30.2个月)。在EGFR突变阴性的患者中,FISH阳性患者比FISH阴性患者有着更长的PFS(4.4个月 vs 2.0个月),FISH出现扩增的患者则更长(5.0个月 vs 2.0个月)。但是,在突变阳性的患者中FISH阳性并不提高PFS。
作者认为,同时进行EGFR FISH和突变检测能更为有效地预测TKI疗效。特别是EGFR基因扩增(copynumber gain, CNG)能从突变阴性的患者中寻找TKI治疗受益的潜在人群。
以下为其部分数据:
1. 扩增阳性PFS和OS更高。
EGFR FISH阳性指的是高多体和成簇扩增,占全部患者的45%,人群特征为女性和不抽烟居多,与FISH阴性比较,PFS 11.2个月 vs 3.0个月;OS 30.2个月 vs 17.2 个月。
2. 突变阳性PFS和OS更高。
252例患者(50.5%)发生突变,其中外显子19缺失有140例,外显子21突变有104例,外显子18突变有3例,且5例有多个外显子突变。与突变阴性比较有着更高的PFS (11.7个月)和OS (30.2个月)。
3. 阳性重叠比例高。突变阳性患者,FISH阳性的PFS和OS稍优。
在252位突变患者中,163(64.7%)位为FISH阳性。FISH阳性与FISH阴性患者在年龄、性别、吸烟状态和组织学方面并无明显相关。与突变阳性但FISH阴性患者相比,突变阳性且FISH阳性患者的PFS和OS虽然稍优,但差异并不明显。
4. 突变阴性中存在1/4 FISH阳性。突变阴性,FISH阳性ORR、DCR、OS更高。FISH检测基因扩增状态差异与PFS相关。
在247位突变阴性的患者中,62位(25%)为FISH阳性且大部分为女性,但与年龄、吸烟状态和组织学并不相关。与突变阴性和FISH阴性患者相比,突变阴性但FISH阳性患者有着明显更优的用药反应率(17% vs 8.6%)和疾病控制率DCR(67.7% vs 35.7%)和OS(25.0个月 vs 14.2个月)。并且,其中FISH为基因成簇扩增者比基因低拷贝者有着更佳的PFS(5.0个月 vs 2.2个月),但OS并无明显差异(16.6个月 vs 15.4个月)。在突变阴性但FISH阳性患者中,无论使用吉非替尼还是厄洛替尼,相关获益都优于突变阴性且FISH阴性患者。
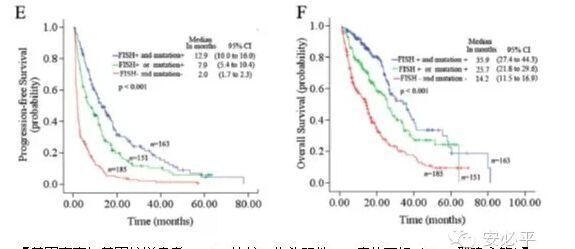
邵建永等的基因扩增与突变人群相互重叠数据与国内的一些数据相吻合。比如,2010年北京协和医院曾瑄等人发表的数据显示,在EGFR基因突变的患者中,有53%(45/85)为FISH阳性;在突变阴性的患者中,有23%(11/43)为FISH阳性。在吴一龙等人的IPASS(东南亚人群)临床试验中,两者相互重叠高度77%!也就是说,基因突变和基因扩增群体相互重叠,只做任何一种检测都可能会遗漏掉部分潜在受益群体,相对于高昂的用药费用而言,有条件的话最好两者都做,如果都为阳性的话其PFS和OS比突变或扩增单独阳性更佳。
并且,尤为重要的是,作者的数据显示EGFR基因扩增的用药受益与基因突变相似(PFS和OS),这似乎为国内首次报道,呈现出不同以往的结果。作者解释是由于基因扩增患者往往与基因突变患者相重叠所导致,但这一结果与IPASS的数据截然不同。这一数据为个别数据偏差导致还是在中国群体中本来就存在?作者的数据量并不小,已经有500多位患者,有一定的代表性。值得后续关注国内更多的数据披露。
二:2011年的三篇综述
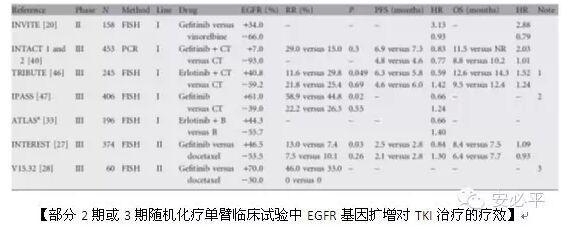
2011年,Dahabreh等人在ClinicalCancer Research和Annals of Oncology上发表了两篇综述,采用历史文献荟萃分析探讨EGFR基因扩增和突变这两个标志物在预测晚期NSCLC患者TKI单药治疗的用药反应率和总生存期方面哪个更佳。同期,Cappuzzo等人针对Dahabreh的研究做了点评(editorial)。
在Clinical CancerResearch这篇综述中,作者分析了222篇文献,最终筛选出21篇用于荟萃分析,涵盖了1539例患者,其中542例出现基因扩增(CNG)。结果显示,EGFR突变在预测TKI单药治疗的用药反应率数据为:灵敏度0.78(95%置信区间0.74-0.82),特异性0.86(95%置信区间0.82-0.89)。而EGFR基因扩增也与TKI治疗的用药反应率密切相关,虽然灵敏度(0.61,95%置信区间0.49-0.71)和特异性(0.71,95%置信区间0.66-0.76)比基因突变偏低。作者认为,与东亚人相比,EGFR基因突变和扩增对白种人TKI用药反应率的预测价值更高。
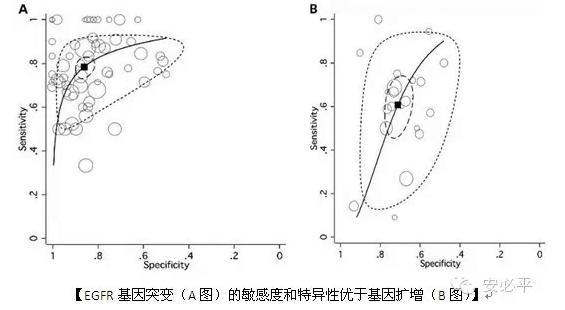
作者也比较了人种差异的数据。与白种人相比,黄种人中EGFR基因突变在不抽烟亚裔女性患者中发生率更高(30% vs 15%),但是KRAS基因突变的发生率却明显低于白种人。作者披露,目前还有很多临床试验正在比较EGFR基因突变和扩增这两个标志物哪个对TKI治疗的用药反应率和预后情况更为有效,如SATURN,TAILOR,TORCH和RADIANT。
在Annals of Oncology的综述中,Dahabreh从255篇相关文献中,提取出20篇(1689位患者,其中594为FISH阳性)用于OS评估;提取出10篇(822位患者,其中290为FISH阳性)用于PFS评估;提取出5篇(294位患者,其中129为FISH阳性)用于TTP(进展时间)评估。
荟萃分析的结果显示,EGFR基因扩增与OS、PFS和TTP延长相关,风险比分别为0.77、0.60和0.50。在主要为白种人的数据中,EGFR基因扩增与总生存期OS强烈相关(风险比为0.70);但是在东亚人群中并无相关(风险比为1.11)。这显示出人种的差异。并且,在东亚人群中,EGFR基因扩增的发生率明显高于白种人(50% vs 31%)。但是,在讨论里,作者也指出,由于东亚数据较少,此结果可能存在一定偏差。(此结果与上文邵建永结果不同)
同期,作为EGFR FISH判读标准的创立人,Colorado大学的Cappuzzo等也在Annals ofOncology撰文做了评论,题目为“Is FSIH floating or still swimming in the lung cancer ocean?”。
作者认为,EGFR基因突变对基因扩增造成了强烈冲击,在考虑TKI用药时应首先考虑突变检测。并且,作者认为FISH还能“still swimming”,但需要改变原先开始的姿势,而用另外一种姿势来游泳,即是强调FISH检测在EGFR突变阴性(野生型)群体中的应用。野生型的NSCLC患者存在高度异质性,需要考虑比如KRAS、ALK和C-MET等多种基因的状态,以期从中筛选适合靶向治疗的野生型患者,而EGFR FISH检测是一个很好的对此类群体近一步分组的起始工具。这与上文邵建永等的思路有一定相似。
三:总结
邵建永等人的数据很好地补充了国内EGFR基因扩增和突变状态对临床TKI用药的预测能力数据。其最大亮点在于,EGFR基因扩增对疗效(PFS和OS)的预测能力与突变相当,这对原来的认识造成很大的冲击,且与2011年的三篇综述有一定的相似性,但又有一定的区别。期待国内更多两种标志物的数据比较。
针对EGFR FISH检测,建议如下使用:
1:医院已具备EGFR突变和FISH双检测平台,应首先进行突变检测,突变阳性无需进行FISH检测。但是,需要了解如果两者都为阳性的话其PFS和OS比单独突变或扩增阳性更佳,有条件的话最好两者都做。若EGFR突变阴性,由于突变和扩增群体不完全重叠,需要继续进行EGFR FISH检测,以期从中筛选出突变阴性/FISH阳性的适合EGFR-TKI用药患者。
2:医院只具备FISH检测平台,可以参照上文邵建永等人的研究结果,EGFR FISH阳性的PFS和OS与突变阳性相当,也可以依据FISH检测结果来进行TKI用药。同时,针对NSCLC患者,FISH平台还可以行ALK断裂、C-MET扩增、ROS1断裂、RET断裂等其他驱动基因检测,以寻找其他合适靶向药物,也适用于EGFR-TKI用药耐药后其他靶标检测。另外,FISH所需的样本远小于突变检测,假如组织不够,应考虑行FISH检测。
3:NSCLC是高度异质性的肿瘤,从EGFR基因扩增有多种形式就可见一斑。站在更为广泛的基因组学来看,肿瘤基因组异常是多基因多通路的互作结果,针对任何一个基因的靶向药物在用药一段时间后都可能会出现耐药,这是肿瘤细胞本身必备的生存能力。因此结合形态学的多平台多靶点检测将有助于耐药机制分析。
4:EGFR单抗药物(西妥昔单抗,帕尼单抗)在结直肠癌中可用于一线治疗,适用于KRAS阴性EGFR表达的结直肠癌患者。而EGFR表达与否的检测方法为IHC和FISH。EGFR FISH检测也可用于结直肠癌患者的治疗前检测。
【参考文献】
1. 邵建永等. High EGFR copy number predicts benefits from tyrosine kinase inhibitortreatment for non-small cell lung cancer patients with wild-type EGFR. Journalof Translational Medicine, 2013, 11:90.
2. DahabrehIJ et al. Somatic EGFRMutation and Gene Copy Gain as Predictive Biomarkers for Response to TyrosineKinase Inhibitors in Non–Small Cell Lung Cancer. Clin Cancer Res., 2010, 16(1).
3. DahabrehIJ et al.EGFR gene copy number as a predictive biomarker for patientsreceiving tyrosine kinase inhibitor treatment: a systematic review andmeta-analysis in non-small-cell
4. lungcancer. Annals of Oncology, 2011, 22:545-552.
5. CappuzzoF et al. Is FISH floating or still swimming in the lung cancer ocean? Annals ofOncology, 2011, 22:493-499.
6. LooyengaBD et al. Tailoring tyrosine kinase inhibitors to fit the lung cancer genome.Translational Oncology, 2011, 4(2):59-70.
7. LiangZY, et al. Relationship between EGFR expression, copy number and mutation inlung adenocarcinomas. BMC Cancer, 2010, 10:376.
8. CappuzzoF et al. EGFR fluorescence in situ hybridisation assay: guidelines forapplication to non-small-cell lung cancer. J Clin Pathol, 2009, 62:970-977.
我要评论




共0条评论