我的博文
1401-0302 霍奇金淋巴瘤.学习
(二)霍奇金淋巴瘤
| 霍奇金淋巴瘤( Hodgkin Lymphoma HL)即霍奇金氏病( HD)。1997年世界卫生组织“淋巴造血组织肿瘤分类”说明中认为近年的研究已经表明本瘤的瘤细胞属性为淋巴细胞,故更名为“霍奇金淋巴瘤”。然而 “HD”的名称已经沿用了一百余年,因此世界卫生组织召开的Airlie House会议决定两个名称均可使用。 |
| 参考资料: |
| 【临床要点】 患者以男性为多,男女比例为2.6:1。发病年龄从幼年至老年(平均年龄为30岁)。往往开始为一无痛性淋巴结肿大,后来出现乏力、发热、盗汗、体重减轻等全身症状以及贫血,有时伴随全身瘙痒。 绝大多数HD都自淋巴结开始,其中以颈部等浅淋巴结和纵隔淋巴结尤为常见。原发于腹腔淋巴结者是很少的。原发于结外淋巴组织如消化道、呼吸道等更为罕见。过去的不少病例经过复习,发现HD的诊断不尽正确,其中不少是非霍奇金淋巴瘤。因为20世纪八十年代以前对黏膜相关淋巴组织的认识还很肤浅,不知道从它发生的非霍奇金淋巴瘤可以出现R-S样的巨细胞。其他如原发于脑、骨等的HD虽文献中时有个案报道,但其可靠性值得怀疑。 |
|
|
| 【病理所见】病变淋巴结增大,粘连成块,质地颇硬。病变中最为特征者乃可见R-S细胞及其变异型。 |
|
|
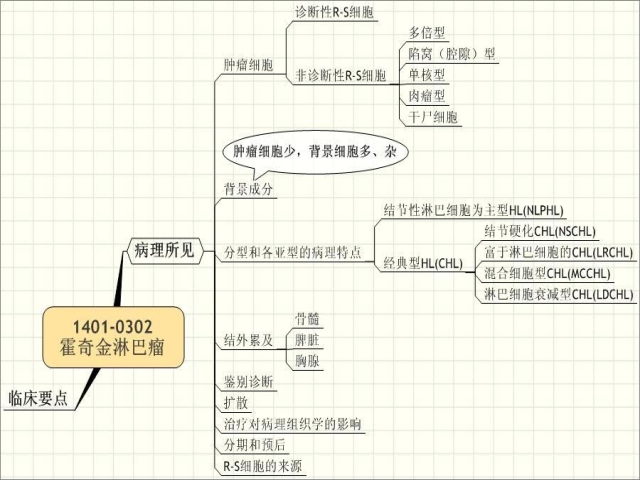
| 1.肿瘤细胞 (1)诊断性R-S细胞 它为一直径15 μm~ 45 μm之巨细胞,胞浆较丰富,嗜双染性。具有两个形态相同,状如鹰眼的所谓“镜影”核。核圆形或卵圆形,染色质稀少,最突出者为各个核均有一个大而红染的包涵体样核仁,其边界清晰,其周围有空晕围绕。识别典型的RS细胞之形态颇为重要,因为众多的淋巴结炎症、反应性病变 和肿瘤时出现的免疫母细胞、转移癌细胞等都可以与RS细胞相似而需要加以鉴别。在实际工作中淋巴结的传染性单核细胞增多症和颈淋巴结的转移性泡状核鼻咽癌被误诊为HL者不在少数。 (2)非诊断性R-S细胞(RS细胞变异型)共四种: ①多倍型:多个核膜极薄,核仁小,染色质稀少的核互相重叠。胞浆透明。在英文文献中俗称“爆米花细胞”。此变异型主要见于淋巴细胞为主型。 ②陷窝(腔隙)型:此型细胞大而圆,胞浆丰富,B-5固 定的材料中呈极淡的粉色,但在甲醛固定的标本中则因胞 浆收缩,在低倍光镜下此细胞所在部位形成空洞,故它在淋 巴细胞等细胞的背景中形成与骨细胞的陷窝相似的小孔而 得名。核1~2个或更多而成串排列,核膜染色质和核仁均与多倍型相似。本变异型主要见于结节硬化型。 ③单核型:其形态相当典型R-S细胞的一半,单个核,又称H细胞,在各类型均可见到。 ④肉瘤型:细胞显著间变,大小形态极不规则。核仁可能还保留一些RS细胞的特点。有时和RS细胞已经相距甚远。此型主要见于淋巴细胞衰减型。 ⑤干尸细胞:它是上述瘤细胞发生凋亡的结果。单个散在分布。胞浆和核均深染,结构不清,在低倍下十分注目。干尸细胞与普通坏死细胞的不同点在于核浆的轮廓仍可辨认,并且它与周围相脱离,以及不成片地出现。虽然它不是霍奇金淋巴瘤所特有的细胞,但在其他病变却很少见。正确辨认它对诊断具有相当价值。 |
| “诊断性R-S细胞”与非诊断性R-S细胞“:在镜检时,如果发现了”非诊断性R-S细胞“,则一定要仔细寻找”诊断性R-S细胞“,必要时需要多切片,甚至再取材,”诊断性R-S细胞“是诊断HL的充分必要条件(注:除外NLPHL)。 引注:①“识别典型的RS细胞之形态颇为重要,因为众多的淋巴结炎症、反应性病变 和肿瘤时出现的免疫母细胞、转移癌细胞等都可以与RS细胞相似而需要加以鉴别”②“在实际工作中淋巴结的传染性单核细胞增多症和颈淋巴结的转移性泡状核鼻咽癌被误诊为HL者不在少数” ① “多倍型”(爆米花细胞 popcorn cell),又简写为L&H细胞 ② “陷窝(腔隙)型”(lacunar type)图例01 -- 图例02 ③ 单核型 图例01 |
| 2.背景成分与肿瘤细胞 相对而言任何肿瘤都有背景细胞存在,但是霍奇金淋巴瘤的背景所占比例及其构成的多样是全身肿瘤中所独一无二的。它可占到肿瘤所有细胞的绝大部分,甚至99%。其构成包括嗜酸性粒细胞、浆细胞、小淋巴细胞、组织细胞、中性粒细胞和间质。小淋巴细胞中多数为T细胞。嗜酸性粒细胞数量可达到相当的程度。中性粒细胞大量存在和“坏死”两者一起与临床上的“B”症状有关。间质如果以无细胞性的胶原为主者比细胞性非胶原的纤维化为主的预后好。 |
| 引注"相对而言任何肿瘤都有背景细胞存在,但是霍奇金淋巴瘤的背景所占比例及其构成的多样是全身肿瘤中所独一无二的。它可占到肿瘤所有细胞的绝大部分,甚至99%". 就如“一粒老鼠屎坏掉一锅汤”,在一锅汤里面去找颗老鼠屎就很不容易! |
| 3.分型和各亚型的病理特点 (1)结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL):nodular lymphocyte predominant HL 本型约占霍奇金淋巴瘤的5%。它是来自相当于滤泡中心母细胞的单克隆性的B细胞肿瘤。男性居多,平均年龄<35岁。很少出现全身症状。绝大多数为I期A或Ⅱ期A。淋巴结肿大进展缓慢。主要在颈淋巴结,其次为腋下和鼠鼷淋巴结。纵隔淋巴结、脾和骨髓很少累及。预后极好,十年生存率高达80%。约3%~ 5%病例可能转化为大B细胞淋巴瘤或其他类型霍奇金淋巴瘤。 病变表现为“结节性”或“结节性伴有弥漫性”(图14-24)。淋巴结的结构基本消失,但可以找到少数残存的滤泡的情况并不少见。低倍光镜下病变呈红蓝斑片状,分别相应于淋巴细胞和组织细胞比较集中的部位。淋巴细胞分化基本良好,组织细胞亦然。多倍型RS细胞数量一般都甚少,必须仔细寻找。单核型和多倍型RS细胞尚能找见,而典型的RS细胞却往往难以找到。比较具有特征性的肿瘤细胞的胞核呈“爆米花样”(图14 -25)。嗜酸性粒细胞、浆细胞和外周的中性粒细胞为数不多,纤维化基本不出现。进行转化生发中心和本型之间具有一定关系。它可存在于病变中,也可出现在 NLPHL之前或之后。其性质是否为肿瘤尚未肯定,所以当在活检中发现进行性转化生发中心时就要谨慎地除外NLPHL的存在。如果还有肿大的淋巴结再次活检是必要的,同时密切随诊。部分结节性病变的周围正常淋巴结组织,包括滤泡和淋巴窦,被压迫而存在于被膜下区域,低倍镜下与病变之间形成弧形分界颇具特征性。 图14-24结节性淋巴细胞为主型霍奇金淋巴瘤 淋巴结结构破坏,由大结节取代 图14-25结节性淋巴细胞为主型霍奇金淋巴瘤 “爆米花”细胞,核呈分叶状,散在分布于小淋巴细胞背景中 CD21、CD35显示结节为滤泡齿突细胞构成的网络,其中绝大多数为B细胞。多倍型RS细胞呈CD20强膜阳性(图14-26)。J链和EMA约见于50%病例。与经典型RS细胞不同,CD15和CD30阴性。近年注意到Oct2和BOB.1对此细胞具有特异性,可用于它和经典型霍奇金淋巴瘤相鉴别。单个多倍型RS细胞的DNA分析可见Ig基因重排。潜伏性EBV感染可能见于淋巴细胞,而不见于多倍型RS细胞。 图14-26结节性淋巴细胞为主型霍奇金淋巴瘤 “爆米花”细胞呈CD20阳性 一般LP往往为临床I期A和Ⅱ期A,很少出现全身症状,一般情况良好,淋巴结增大缓慢,因此不少缺乏经验的病理医师会在诊断时发生迟疑,尤其病变中找不到典型的R-S细胞时。 LP在诊断时需要与免疫母细胞性淋巴结反应性增生、传染性单核细胞增生症、富于T细胞的大B细胞淋巴瘤及高分化淋巴细胞淋巴瘤等相鉴别。多倍型和典型R-S细胞的发现有重大的意义。 (2)经典型霍奇金淋巴瘤(classic, Hodgkin's lymphoma):绝大多数来自滤泡中心细胞(达98%),极少数来自外周T细胞。它有四种亚型,其中的H/RS细胞的免疫表型及遗传特征都相同,但其临床表现和EB病毒的伴随有所区别。经典型H/RS细胞都CD30+、CD15+/- CD68-。由PAX5基因编码的产物-B细胞特异性活化物蛋白(B cell activator protien BSAP)阳性见于约95%病例。EMA -和BSAP+不同于Ki-l(+)大细胞间变性淋巴瘤,因此可用于两者的鉴别。CD45阴性,并一般T/B细胞相关抗原都阴性是与非霍奇金淋巴瘤的重要 区别。EB病毒编码的潜伏膜蛋白( LMP)在部分病例阳性,其阳性率随各亚型和发病地区而异。 ①结节硬化经典霍奇金淋巴瘤( nodular sclerosis classic Hodgkin's lymphoma,NSCHL) 本型以好发于女性,发病年龄多在20~ 40岁之间,累及纵隔的比例特别高等特点有别于其他亚型。在西方国家占诸亚型之首位,占HL总数之50%~ 70%。就诊时多为I期A和Ⅱ期A,个别则为Ⅱ期B和Ⅲ期B,具有B症状者约占40%。 病变以淋巴结被膜结缔组织增生高度增厚并深入淋巴结实质将病变组织分割成结节状构造以及陷窝型细胞的存在为两大特征(图14-27)。增生结缔组织之胶原纤维平行排列并玻璃样变,并在偏光显微镜下呈双折光性等特点可区别于淋巴细胞衰减型中的广泛弥漫纤维化。结节内的病变中陷窝型细胞一般不难找见。有时甚至数目甚多而连成片,称为“合体细胞型结节硬化”,此类型并无特有的临床特点和预后经过,只是在诊断中需要与转移癌、黑色素瘤、生殖细胞瘤等相区别。 图14-27 结节硬化经典霍奇金淋巴瘤 陷窝型RS细胞散在分布于小淋巴细胞、浆细胞和 嗜酸性粒细胞组成的背景中 为了进一步提高结节硬化型的疗效,英国学者对占全部HL病例一半以上的NS病例区别对待,根据病变结节的组成成分将NS分为二十三种亚型,经归并后成七种亚型(LP、LP-MC、MC、MC伴有纤维化,MC伴有瘤细胞多形性,MC-LD,LD)。为了在实际应用中更加简明并提高重复性,将前四种合为一级 ( Grade I)。 后三种合为二级( GradeⅡ)。GI和GⅡ在治疗和预后方面具有显著的差别,十年生存率为72%和47%。因此在作NS病理诊断时没有进一步注明GI和GⅡ是不够完善的。 ②富于淋巴细胞的经典霍奇金淋巴瘤(Lymphocyte Rich Classical Hodgkin Lymphoma, LRCHL) 本型以H/RS细胞散在子结节或弥漫的富于大量淋巴细胞而缺乏中性粒细胞和嗜酸性粒细胞的背景为特征。1994年REAL分类中首次出现这个诊断,作为 暂定型提出,2001年WHO分类中明确列为独立类型。它和NLPHL具有不少共同之处,譬如发病率约5%,大多数病人为I期或Ⅱ期,“B”症状少见,男 性占79%,预后好等。惟反复复发比NLPHL为少,如果复发则其预后比NLPHL的复发差。 病变呈现结节性者较多。弥漫性者较少。其中的肿瘤细胞不仅多,而且它的形态及免疫表型都为经典型的RS细胞,因此有别于NLPHL。镜下形态和 NLPHL,NS,MC都有重叠。病变结节以小淋巴细胞为主,其中可能还有退化的生发中心。中性粒细胞、嗜酸性粒细胞和浆细胞都很少(此点不同于MC和 NS),并且不难找到典型的RS细胞(此点有别于NLPHL),常位于扩展的外套层中。弥漫性病变的小淋巴细胞(几乎都是T细胞)背景里可能混杂有多数组 织细胞(图14-28)。图14-28富于淋巴细胞的经典霍奇金淋巴瘤单核型RS细胞散在分布于小淋巴细胞组成的背景中。 ③混合细胞型经典霍奇金淋巴瘤(Mixed cellularity classical Hodgkin lymphoma , MCCHL) 本型是介于惰性的LP和侵袭性的LD之间的“中间型”。实际上它包容着所有不具备LP,NS,和LD典型特点的病例。它的病变成分也介于LP和LD两个 极端之间,以多种成分的细胞组成为特征。小淋巴细胞、组织细胞、嗜酸性粒细胞、浆细胞、中性粒细胞等都易找见。单核型RS变异型数量多少不等,但一般不难看到(图14 -29)。典型R-S细胞也总能找到。小坏死灶可有可无,纤维化亦然。有些病例嗜酸性粒细胞极多,甚至形成“嗜酸性 图14-29 混合型经典霍奇金淋巴瘤单核型RS细胞散在分布于小淋巴细胞、浆细胞、 嗜酸性粒细胞和组织细胞组成的背景中脓肿”。EBV感染的证据一“LMP”的检出率比其他类型高,约为75%左右(图14-30)。平均年龄为37岁。 “B”症状,Ⅲ期及Ⅳ期都很常见。脾累及约见于30%,骨髓累及见于10%。 图14-30 混合型经典霍奇金淋巴瘤 HRS细胞呈EBV潜伏期膜蛋白抗原(LMP-1)阳性 ④淋巴细胞衰减型经典霍奇金淋巴瘤(lymphocyte depleted classical Hodgkin lymphoma, LDCHL) 此型具有三个特点:淋巴细胞显著减少、RS细胞丰富而间变以及不同程度的纤维化。因此低倍光镜下病变淋巴结看来细胞成分疏松而成所谓“荒芜"图像。肿瘤细胞与其他各种细胞成分的比例较之LP和MC相对较多,肿瘤细胞间变明显,单核或多核有时与RS细胞及单核型相距甚远,此乃所谓“肉瘤型或变异型RS细 胞”(图14-31)。坏死灶和纤维化均不少见。坏死区呈红染之蛋白性纤维状物质。纤维化灶不呈双折光性,而与NS相区别。 图14-31 淋巴细胞消减型经典霍奇金淋巴瘤肉瘸型RS细胞及中等大瘤细胞增多,淋巴细胞减少 本型最为少见,男性占75%。主要发生在腹腔及腹膜后淋巴结。骨髓常累及。外周淋巴结比较少见。多为Ⅲ期或Ⅳ期,常伴有“B”症状。过去本型病呈侵袭,预后很差,但是应用了现代治疗手段以后,其预后和临床分期相同的其他经典型相似。 五种类型的划分在一般的病例都能作出,遇到交界病例时下列诊断标准有助于划界:在LP病变背景中典型的R-S细胞较容易找见时应划为MC。NS的病变结 节虽有结缔组织间隔但无双折光性硬化时也划为MC。只有整个淋巴结都为淋巴细胞衰减的形态表现才划分LD,如果还有些区域结节形成,并有陷窝型变异型和双折光性胶原存在则划分为NSGII。在MC病变中出现LP和LD区域和陷窝型变异型(但无硬化一所谓“NS细胞期”)在生存方面并无区别。 |
| (1)结节性淋巴细胞为主型(NLPHL): 光镜图例:01(8图) 参考资料:01 维基解释 (2)经典型何杰金淋巴瘤 ①结节硬化型经典HL 引注: 本型临床特点①女性好发 ②多有累及纵隔 ③年龄多在20-40岁间④发病比例高(占总HL的50%-70%); 组织病理特点:①淋巴结被膜高度增厚并深入分隔②陷窝型细胞存在 学习资料:切片学习 01 ②富于淋巴细胞的经典HL: ③ 混合细胞型HL: 参考资料:01 ④ 淋巴细胞消减型(LDCHL): 光镜图例 01(5图) |
| 4.结外累及 骨髓中没有淋巴管,所以骨髓中肿瘤浸润即意味着血行播散(Ⅳ期)。转移性HL病灶常表现为纤维化,其周围可有少量出血,RS细胞往往不容易找见,因此常成为诊断难题。病变多为局限性,经常须多处活检才能获得诊断。 脾累及约见于20%。病变累及白髓而不累及红髓是霍奇金淋巴瘤的特点。脾大小正常并不能除外脾的累及,甚至小于正常的脾也可能存在病变。此乃所谓“隐性霍奇金淋巴瘤”,脾的病变可以很小,因此在病检时须切成2~3mm的薄片,而且多处取材,才不致遗漏。 胸腺累及时常发生“囊性变”,并发生显著上皮样肉芽肿反应,因此极易误诊为“肉芽肿性胸腺瘤”,需要特别谨慎。其他结外累及常常组织学改变很不典型,经常不能界定它的亚型。 |
|
|
| 5.鉴别诊断 HD病变多样,始终是病理诊断中的一大难点。在较早期的病变淋巴结,病变仅累及副皮质区而有相当数量的反应性滤泡存在的话,缺乏经验的医生在诊断时会迟疑不决。现将此种病变专门命名为“滤泡间HD”以资提醒,防止遗漏。HD大多数自淋巴结的副皮质开始,所以残存个别反应性滤泡是不足为奇的。 最常与霍奇金淋巴瘤相混淆而导致误诊的疾病有反应性增生(包括非特异性淋巴结炎,传染性单核细胞增生症、抗痉厥药物淋巴结病、异常免疫反应、血管免疫母细胞性淋巴结病)、颈淋巴结鼻咽癌转移、非霍奇金淋巴瘤(尤其T细胞淋巴瘤、大细胞间变性淋巴瘤)等。对黏膜相关淋巴瘤和其他结外淋巴瘤的病变变化幅度的生疏也可能误诊为霍奇金淋巴瘤。1999年Fellbaum报告了一种“相似于霍奇金淋巴瘤的淋巴结炎”更需分外注意。 |
|
|
| 6.扩散 霍奇金淋巴瘤有两种扩散方式,连续扩散和断续扩散。根据大量深入的分期研究表明前者占98%,所以连续扩散是霍奇金淋巴瘤的主要方式。连续扩散可通过:①经由输出淋巴管从一组淋巴结扩展到下一组所谓“下游淋巴结”。②直接扩展到邻近软组织,再侵犯结外器官。连续扩散是设计霍奇金淋巴瘤放射治疗的基础。不仅要对病变区淋巴结进行放射,而且放射野还要包括其上游淋巴结。 断续扩散有经淋巴管逆流和经血管扩散两种方式。组织切片上可以观察到淋巴结的输入/出淋巴管和淋巴窦内存在包括RS细胞在内的霍奇金病变,以及淋巴结旁软组织的动脉腔内及动脉壁霍奇金病变浸润。淋巴管扩散比血管扩散阶段要早若干年。淋巴管扩散的范围可以估计,局部治疗常可奏效。到了血管扩散阶段进展就非常迅速。循血管扩散到脑膜、胃肠、肌肉的病例极为少见,仅见于广泛进行性致死病例和并发HIV感染的病例,因此不要在上述部位轻易作霍奇金淋巴瘤的诊断。 过去主要依靠剖腹探查(CT和磁共振还不普遍时)进行HL的病理分期时发现本病血播的规律:①脾往往是血行转移最早的部位。②肝的转移都继发于脾的病变,没有脾的病变而出现肝转移的病例是很少的。③在腹腔淋巴结中脾门淋巴结和腹腔淋巴结最常累及,而肠系膜淋巴结则很少累及。④脾的病变为灶性分布,因此病检时必须切成很薄的薄片以免遗漏。每见一处肉眼检查有怀疑的部位都应取材作切片检查。⑤脾内病灶的数目与预后有关。一般脾重超过四百克者几乎都有累及,但在四百克以下者也不排除阳性的可能。 连续扩散多见于淋巴细胞为主型及结节硬化型。淋巴细胞衰减型和侵袭性强的混和细胞型可发生血管扩散。 |
|
参考文献: |
| 7.治疗对病理组织学的影响 霍奇金淋巴瘤经治疗后病理组织学可发生重大改变,以至根据病变难于作出诊断。尸解标本中往往很难找到RS细胞,有时可与非霍奇金淋巴瘤相混淆。治疗后形成的“局灶性玻璃样变疤痕”可不消散而长期存在,临床上可误认为疾病没有治愈。化疗及放疗后长期生存者少数后来出现白血病等造血系统肿瘤,这些肿瘤对治疗 常不敏感,因而预后不良。何时为第二肿瘤出现的高峰尚不清楚,因在首次治疗十年后还可继续出现。 |
|
|
| 8.分期和预后 既往HL的亚型对预后有很大的影响。近年来由于高压放疗等治疗手段的进步,部分地抹杀了五种亚型在预后的差异。在影响预后方面临床分期起着更重要的作用。I和Ⅱ期A目前五年生存率几乎达到百分之百。Ⅲ和Ⅳ期患者中50%可达到长期无瘤生存。但是由于各国治疗手段的差别以及社会经济状况和收治患者对象的不同,HL的治愈率和生存率有很大的差距(表14-4)。 分期对治疗及预后都至为重要,对局现病变采用扩大放射或全身淋巴结放射。播散病例则采用联合化疗。 和预后有关的因素有:①有无三大症状,即“A”抑“B”。②大块病变者预后不良(尤在纵隔)。③广泛脾累及、肝累及和骨髓累及者预后不良。④高于60岁者预后不良。上述因素不仅影响预后,还决定治疗方案的选择,如有“B”症状,纵隔有大肿块者就须用放疗结合化疗。 表14-4 Cotswolds会议(1989)修订Ann Arbor分期 I 累及一个淋巴结区或结外某淋巴结构(如脾,胸腺,韦氏环等)。 Ⅱ 累及横膈一侧的两个或两个以上淋巴结区。累及的部位数用附缀表明(如Ⅱ.3)。 Ⅲ 累及横膈两侧的淋巴结区或结外淋巴结构。 Ⅲ-1伴随或不伴随脾,肺门,腹腔,或肝门淋巴结累及 Ⅲ-2伴有主动脉旁,髂,肠系膜淋巴结累及 Ⅳ 累及超越I期中某一结外淋巴结构的结外部位 |
|
|
| 9.R-S细胞的来源 历来对RS细胞的来源有组织细胞源和淋巴细胞源两种观点。Rappaport(1966年)基于一般染色切片的光镜观察,认为R-S细胞是非典型组织细胞。Mori和Lennert(1969年)从电镜观察认为它是异常的网状细胞。Kaplan(1977年)根据体外培养和异位移植的观察认为RS细胞是肿瘤性巨噬细胞。而Lukes等对传染性单核细胞增生症的研究,看到从免疫母细胞转化为R-S细胞的形态,因此认为RS细胞来自B细胞。Leech(1973年)用抗人Ig发现R-S细胞呈点状的膜荧光和或胞浆内斑点荧光而证实具有合成Ig的能力,这是R-S细胞来自B细胞的有为证据。然而进一步观察发现大多数R-S细胞的胞浆Ig是多克隆的,似乎表明R-S细胞的胞浆Ig并非自身所合成而是从环境中吸收Ig的结果。1982年 Schaadt等通过单克隆抗体研究证明RS细胞来自淋巴组织中一种以前未被认识的细胞群-Ki-l阳性细胞。他们发现在一培养成功的霍奇金淋巴瘤细胞株 (Ki-1)对各种已知针对T细胞、B细胞、巨噬细胞、交指状齿突细胞、滤泡齿突细胞、红细胞、血小板的抗体皆阴性,而各种HD类型的R-S细胞均对用 Ki-l阳性细胞株免疫小鼠而制备得到的单克隆抗体呈阳性反应。因此认为霍奇金淋巴瘤就是来自这种特殊的“Ki-l阳性细胞”。现知Ki-l (CD30 IHC染色图例)是存在于高度活化的淋巴细胞(T和B)表面的抗原,故R-S细胞来自某种淋巴细胞,绝大多数病例为相当于生发中心母细胞阶段的B细胞。 |
|
|
|
|
|
|
我要评论




共0条评论