我的博文
尤文肉瘤及其类似且可能相关的小圆细胞肿瘤的发展史:我们从何方来,要到何方去?
摘要:小圆细胞肿瘤的诊断一直是非常困难的,且其分类在不断发展变化。自从詹姆斯·尤文博士首次发现这一肿瘤后,“尤文肉瘤”这个名称下的历史背景就发生了变化。尽管尤文肉瘤和原始神经外胚层肿瘤都是在20世纪初被首次描述的,但这些肿瘤在同一个世纪末(大约75年后)被认为可能是不同的实体。随着现代免疫组织化学和分子技术的进步,人们对尤文肉瘤和尤文样肿瘤的认识有了很大的提高,但也提出了新的问题和挑战。我们现在知道,这类肿瘤明显比最初认为的更具异质性,特别是在其细胞遗传学和分子特征方面,其中一些差异可能具有预后相关性。无论我们现在是扩大尤文肉瘤的范围,还是仅仅认识新的独立的疾病,都是有争议的。解决这些新类别和/或独立的疾病的治疗方法需要进一步关注。因此,我们综述了尤文肉瘤、尤文样肿瘤(CIC和BCOR重排肉瘤)和相关和/或类似的小圆细胞肿瘤(间叶性软骨肉瘤、促结缔组织增生性小圆细胞肿瘤和小细胞骨肉瘤)的研究进展及历史展望。我们还试图提供关于尤文肿瘤家族进一步分类和临床相关性的最新信息和见解。
尤文肉瘤的历史背景
在中国共产党成立的那一年,关于最终会以他的名字命名的肿瘤,詹姆斯·尤文[James Ewing]写道:“多年来,我在刮除的骨肿瘤标本中遇到了一种组织形态学结构与骨肉瘤和骨髓累均明显不同的肿瘤,必须用模糊的术语‘未知起源的圆形细胞肉瘤’来表示。”形态学上,肿瘤由小的多面体细胞组成,细胞核深染、胞质淡染且边界清晰,但与任何细胞间物质或骨形成无关。在一些病例中,肿瘤细胞在血管周围形成所谓的“周皮[perithelial]”排列,或形成与血管无关的圆形群,即“菊形团”。临床上,这种独特的肿瘤好发于长骨轴(骨干),放射治疗时具有快速消退的特点。因为尤文错误地认为该肿瘤细胞是血管源性的(可能部分与“周皮”生长的倾向有关),他将该肿瘤命名为:弥漫性内皮瘤[diffuse endothelioma]。相反,Oberling假设尤文肉瘤的肿瘤细胞来源于骨髓中不成熟的网状细胞,因此提出用骨髓网状肉瘤[reticulosarcoma of the bone marrow]这个术语。不幸的是,这个诊断术语导致的混乱[confusion]比澄清[clarification]更多,因为“网状肉瘤”的名称也可以应用于淋巴和骨髓起源的肿瘤。应该指出的是,Parker和Jackson最初认为的“网状细胞肉瘤”通过辅助技术被证实是骨原发性淋巴瘤。在对尤文肉瘤进行初步描述后不久,Codman医生和他的同事Ewing及Bloodgood医生共同成立了美国外科医师学会骨肉瘤登记委员会[Committee on the Registry of Bone Sarcoma of the American College of Surgeons],旨在规范骨肿瘤的命名。Codman在1925年出版的关于骨肉瘤的教科书中评论道:“作为一种分类,我们以尤文的名义命名这个肿瘤,不会违背他的意愿,也不会让他感到羞愧,因为他并不会经常否认一个登记者试图以他的名义登记肿瘤。”尽管尤文提出了反对意见,但这种肿瘤很快就被称为“尤文肿瘤”[Ewing’s tumor]。Codman进一步承认,在那些对登记感兴趣的人中,他们中的大多数人可能认为,在成骨未分化肉瘤的标题下,它更适合我们的分类,而不是内皮瘤[endothelioma]。几十年后,Jaffe试图使用“尤文肉瘤的中性名称”[neutral name of Ewing’s sarcoma],这有额外的优势,表明尤文在实体肿瘤划分方面的先驱工作。虽然发生于骨的尤文肉瘤已成为公认的和可重复的诊断,但直到今天关于它的组织学发生仍存在相当大的争议和争论。众所周知,放射治疗会导致原发性肿瘤完全“消失”,但预后仍然较差,绝大多数患者在最初诊断后的几年内会死于转移性疾病。
至少在20世纪80年代以前,尤文肉瘤的诊断几乎完全依赖于先前描述的形态学和临床病理学特征。肿瘤对放射治疗有如此良好的反应,这一事实被认为该肿瘤的诊断是正确的。这种诊断方法存在问题是不足为奇的。早在1940年,Willis就正确地指出,骨转移的神经母细胞瘤可以模仿尤文肉瘤,根据他的报告,他试图对早期诊断的尤文肉瘤提出相当大的怀疑,认为尤文肉瘤可能被误诊为神经母细胞瘤。他发表了2名最初出现骨肿瘤的患者的结果,这些患者似乎具有尤文肉瘤公认的临床、放射学和形态学标准。此外,临床过程(包括肿瘤对放射治疗的敏感性)也支持这种感觉[impression]。然而,随后对两名患者进行尸检,均发现原发性神经母细胞瘤,其中一个位于肾上腺,另一个位于左腰交感链,证实了最初的骨病变实际上是转移性神经母细胞瘤。据观察,神经母细胞瘤典型的“菊形团”在转移性病变中并不明显,但在原发性肿瘤中很容易识别。大多数病理学家认为威利斯的资料说明在确定尤文肉瘤的诊断时要谨慎。
如前所述,大多数早期研究者不接受尤文肉瘤是内皮起源[endothelial origin]的肿瘤这一观点。Lichtenstein和Jaffe也反对这一说法,他们认为肿瘤是由一些原始间质或骨髓网状细胞引起的。1971年,AFIP将尤文肉瘤归类为“骨髓起源”的肿瘤。早期的电子显微镜研究也倾向于后者,显示细胞器相对较少,糖原颗粒丰富,单层质膜。Schajowicz于1959年首次报道尤文肉瘤和“网状细胞肉瘤”在PAS染色上存在差异。在这些病例中,他很容易在所有8个尤文肉瘤的细胞中发现糖原,但在9个网状细胞肉瘤的细胞中没有发现糖原。在存档的福尔马林固定的组织中糖原检测不太成功,因为剩下的43例尤文肉瘤病例中只有一半显示有糖原颗粒,然而所有22例福尔马林固定的网状细胞肉瘤病例均缺乏糖原。其他人也证实了类似的发现,包括神经母细胞瘤中没有这种染色。然而,这种热情[enthusiasm]是短暂的,因为1978年和1979年随后的报告发现有高达10%~20%的神经母细胞瘤存在丰富的胞质内糖原。似乎小圆细胞肿瘤中糖原的检测对鉴别尤文肉瘤有帮助(但并非总是如此),但也依赖于固定方法,也许不像人们希望的那样敏感。
可争辩的[Arguably],Tefft等人于1969年首次描述了骨外尤文肉瘤的病例。他们的研究包括4例在形态上类似于尤文肉瘤的儿童病例,这些病变发生在脊柱旁,没有骨来源的证据。1975年,Angervall和Enzinger证实了另外39例起源于软组织的小细胞肉瘤(骨外尤文肉瘤),主要影响年轻成人,组织学上与骨尤文肉瘤无法区分。在所有的“选定”病例中都记录了胞质内糖原。与骨肿瘤相似,骨外尤文肉瘤的临床过程在大多数患者中是致命的,最终以广泛肺和骨转移而死亡。
尤文肉瘤的形态学多样性在改革开放那一年首次得到了充分而准确的描述。Llombart-Bosch等人利用光学显微镜和超微结构检查来描述两组尤文肉瘤病例,分为经典型和非经典型。Nascimento等人在1980年通过分析20例大细胞(非经典型)骨尤文肉瘤(占1978年梅奥诊所连续见到347例尤文肉瘤的5.8%)后进一步阐述了该病的临床病理学特征:肿瘤细胞明显大于经典型的尤文肉瘤细胞,常有明显的核仁。非经典型与经典型尤文肉瘤在临床表现方面无明显差异。
1983年,Aurias等人在《新英格兰医学杂志》上报道了4例尤文肉瘤,2例存在t(11;22)(q24;q12) ,1例存在t(2;22;11) ,1例存在t(9;22;20)。在这本杂志的同一期中,Turc-Carel等人在3例尤文肉瘤患者的4个细胞系中发现了相同的t(11;22)。这些发现似乎证实了尤文肉瘤实际上是一个具有独特临床病理的疾病实体,正如60年前詹姆斯·尤文最初提出的那样。然而,正如我们将要讨论的,虽然到21世纪的尤文肉瘤(及其家族)的进一步分子遗传学检测有助于更好地描述和扩大其形态谱,但它最终也使诊断复杂化。
外周原始神经外胚层肿瘤(PNET)的历史背景
尽管事实上PNET比尤文肉瘤发现得早,但接受PNET(或外周神经上皮瘤)作为一个独特的实体需要几十年。与尤文肉瘤相比,对PNET诊断的反对更大,因为许多研究者认为其组织发生起源于神经嵴,与神经母细胞瘤难以区分。在尤文发现一个14岁女孩桡骨“弥漫性内皮瘤”的前3年,Stout医生描述了一个发生42岁男性尺神经的肿瘤由小圆形细胞组成,并有菊形团形成。他后来根据组织培养结果推测,这种病变可能与神经母细胞瘤有关。可以肯定的是,人们认识到(并记录在案)尤文肉瘤很少表现出菊形团和/或假菊形团结构。然而,根据Jaffe的说法,“如果有人研究相关的插图[illustrations],我们可以看到这些结构的中心代表退化的细胞,其轮廓仍然可辨认,而不是神经母细胞瘤中的纤维状或颗粒状轴心。Stout认为这些假菊形团不是“退化”的结果,而是否定了解释。
20世纪后期,PNET的诊断扩展到软组织肿瘤,不涉及周围神经和骨起源。1975年,Seemayer等人发表了一系列软组织肿瘤,其形态与Stout最初描述的相似,但不涉及周围神经。Jaffe等人于1984年报道了4例发生骨的小圆细胞肿瘤,具有尤文肉瘤的临床和影像学特征,没有儿茶酚胺分泌,也没有分叶状生长模式及Homer-Wright菊形团这种形态学结构。电子显微镜下仅有1例出现稀少的神经分泌颗粒。结论是,至少部分发生于儿童骨和软组织的小圆细胞肿瘤,虽然表现为尤文肉瘤,但本质上是神经外胚层肿瘤。其对PNET的定义包括以下至少一项:(1)确定的神经纤维丝;(2)神经节细胞分化;(3)神经源性的超微结构证据(神经分泌颗粒或具有形成微管的过程)。
在《新英格兰医学杂志》首次报道尤文肉瘤存在t(11;22)(q24;q12)后的一年,Whang-Peng等人在2例PNET患者的肿瘤标本和肿瘤细胞系中报告了相同的核型。根据无肾上腺肿块和儿茶酚胺水平升高、NSE(一种神经源性肿瘤的特异性标记物,在尤文肉瘤中不存在)染色阳性,这些肿瘤被归类为PNET。然而,作者通过提出尤文肉瘤和PNET具有共同的组织学发生来总结他们的发现。
Askin瘤的历史背景
1979年,Askin等人在20名儿童/青少年中描述了一种“胸肺区恶性小细胞肿瘤”,这种肿瘤经常局部复发,没有像儿童时期的其他小圆形细胞肿瘤那样广泛转移。作者谈论到,“从临床和病理角度来看,与我们的20例病例最相似的肿瘤是尤文肉瘤。”据报道,大约一半的病例(后来被称为“Askin's瘤”)含有类似于所谓Homer-Wright假菊形团的菊形团样结构。然而,本研究只是用PAS染色证实是糖原缺乏的肿瘤。作者承认,“我们的一些病例可能仍然是发生于软组织的尤文肉瘤。”Gonzalez-Crussi等人于1984年分析了12例累及胸壁伴肋骨破坏的尤文肉瘤(和尤文样肉瘤),结果显示没有胸外累及的迹象。只有3例符合胸壁PNET标准,具有菊形团形成、纤维丝背景、内皮增生和提示神经组织发生的超微结构特征。这些患者的预后特别差。总之,作者认为他们的病例与Askin之前描述的“儿童胸肺区恶性小细胞肿瘤”相似,但对于“这是有先例的病例”更倾向于用“外周神经外胚层肿瘤”来形容。Linnoila等人于1986年将Askin瘤的诊断(和定义)扩展到包括“PAS阳性”的肿瘤。在他们报道的15例患者中,4例可见菊形团形成,10例PAS阳性,10例NSE阳性,10例电镜下可见神经分泌颗粒。作者提到,由于Askin瘤HE染色表现为原始外观[primitive appearance]且PAS阳性,通常被误诊为尤文肉瘤。NSE免疫染色和电镜检查被认为是鉴别的必要条件。
在发现尤文肉瘤中存在t(11;22)后的两年,Seemayer等人报道了一个发生年轻女孩胸壁和肺(Askin瘤)的恶性肿瘤具有相同的染色体易位。上述发现支持Askin瘤是来源于神经上皮的肿瘤。
预示结果的前兆------我们是一个整体?
虽然认识到尤文肉瘤、Askin瘤和PNET在形态上有重叠,但20世纪后半叶,医学界大部分学者继续认为它们是不同的临床病理实体,可能具有共同的组织学发生,但并不是同一肿瘤的不同谱系。正是由于这些诊断缺乏可重复性,加上随后的辅助检查结果有重叠性,特别是免疫组化和细胞遗传学,开始慢慢开始挑战并最终推翻了这一假设。早在1986年,Whang-Peng等人就对包括尤文肉瘤、小细胞骨肉瘤、神经母细胞瘤、PNET和Askin瘤在内的一组小圆形细胞肿瘤进行了细胞遗传学评价,对于尤文肉瘤、PNET和Askin瘤,作者发现了一个相同且不可区分的t(11;22)。1989年,Ushigome等检测了14例尤文肉瘤、4例骨外尤文肉瘤和9例PNET的免疫组织化学和超微结构特征,并与神经母细胞瘤和嗅神经母细胞瘤进行比较。18例尤文肉瘤中有16例糖原丰富,9例PNET中有7例糖原丰富。电镜进一步显示,尤文肉瘤和PNET的原始细胞具有神经分泌颗粒和微管形成。免疫组化染色显示,NSE、神经母细胞瘤细胞表面抗原、神经元细胞表面抗原和神经纤维丝不仅在神经母细胞瘤中表达,而且在尤文肉瘤、骨外尤文肉瘤和PNET中也常有表达。因此,作者的结论是尤文肉瘤和PNET都起源于神经外胚层。Contesso等人对30例Askin瘤与发生于胸外的26例经典型尤文肉瘤进行比较,发现这两个肿瘤没有明显的免疫组化方面差异。3例Askin瘤具有神经分泌颗粒的超微结构证据。他们的结论是:所有恶性小圆形细胞肿瘤(包括Askin瘤和尤文肉瘤)之间具有明显的相似性。
把尤文肉瘤与PNET区分开一直是主观性的,尽管越来越多的证据表明两者之间存在关系,但这种区别仍然被认为是必要的,因为PNET最初被一些人认为预后较差。1991年,来自Kiel儿科登记处的Schmidt等人提出了一种基于光镜和免疫组织化学发现的新分类系统。Homer-Wright菊形团的存在和/或至少2个神经标记物表达阳性被认为是PNET的诊断标准。经典型尤文肉瘤没有菊形团结构,最多一个神经标记物表达阳性。据报道,尤文肉瘤的7.5年无病生存率为60%,PNET为45%。不幸的是,后来的研究不支持这些结果。国家癌症研究所和圣犹德儿童研究医院的一项研究分析了63名“类似治疗的儿童和青年成人患者”,并将结果与临床结果进行了比较。在60例(39例PNET、21例尤文肉瘤)中采用上述Kiel标准对肿瘤进行分类,或在61例(14例PNET;21例非典型尤文肉瘤;26例尤文肉瘤)中采用超微结构检查改良分类方法。两种分类均未观察到无事件或无疾病生存率存在差异。如上文所述,所谓的“神经外胚层分化”在临床结果中不起作用。Terrier等人还对来自欧洲和美国癌症中心的315例原发性尤文肉瘤(220例经典型、48例非经典型、47例PNET)进行了大规模回顾性研究。他们的结论是“神经外胚层特征”与预后无关。1996年梅奥临床研究回顾了21例软组织尤文肉瘤和13例PNET。两组患者在诊断、性别、肿瘤部位或发病年龄方面均无统计学差异。尤文肉瘤的5年总生存率为50%,PNET为44%;尤文肉瘤和PNET的5年无病生存率均为33%。治疗方法基本相同,包括手术和辅助治疗(放疗和/或化疗)。从临床角度来看,得出的结论是:这两个肿瘤非常相似。
CD99(MIC2P30-32)---不再是排除性诊断指标
在20世纪的大部分时间里,尤文肉瘤唯一总是阳性的免疫组化标志物是波形蛋白。除一些非特异性神经标记物(如NSE)外,尤文肉瘤通常是排除性诊断。光镜下可见糖原虽然有用,但不被认为是“诊断所必需的”。然而,随着对CD99抗原抗体的识别和应用,这种状态开始发生变化。MIC2是X和Y染色体上的一个假常染色体基因,编码糖蛋白p30/32Mic2(CD99),在尤文肉瘤(及其谱系PNET)中高度表达但不完全表达。最早针对CD99的抗体研究集中在T细胞上;然而,基因产物似乎在几乎所有人体组织中普遍表达,从非常有限和不可检测到明显过度表达。迄今为止,几乎所有的研究都发现CD99的表达对尤文肉瘤的诊断高度敏感,从87%到100%不等,通常表现为弥漫性膜染色。然而,这种特异性似乎不太可靠,因为其他小圆细胞肿瘤(包括促结缔组织增生性小圆细胞肿瘤、腺泡状横纹肌肉瘤、胚胎横纹肌肉瘤以及小细胞骨肉瘤)中也有一定的表达。事实上,Stevenson等人的早期研究中,CD99膜染色阳性的促结缔组织增生性小圆细胞肿瘤和小细胞骨肉瘤被诊断为尤文肉瘤。然而,我们认为,只要形态学和临床病理具有相对特征,弥漫膜CD99阳性仍然是一个非常有用的标记,具有很高的敏感性,有助于帮助诊断。正如我们稍后将要讨论的,在一个尤文样肉瘤中存在斑片状的CD99表达增加了其他基因改变的可能性,可能表明它们是不同的疾病实体。
现代分子病理学与新变种(或不同病种)的识别
在尤文肉瘤中发现t(11;22) 最初是为了证实和扩大尤文肉瘤的形态谱,包括大多数所谓的非典型(大细胞)形态和那些具有更不寻常特征的形态,如造釉细胞瘤样。然而,总有部分(约10~15%)病例无此染色体易位。下面的讨论旨在总结我们目前关于尤文肉瘤(和尤文样肉瘤)和现代分子病理学相关知识。也将讨论我们是否已经确定了尤文肉瘤的各种形态学亚型或新的病种。表1总结了已知与所谓的尤文肉瘤家族肿瘤相关的遗传学内容。
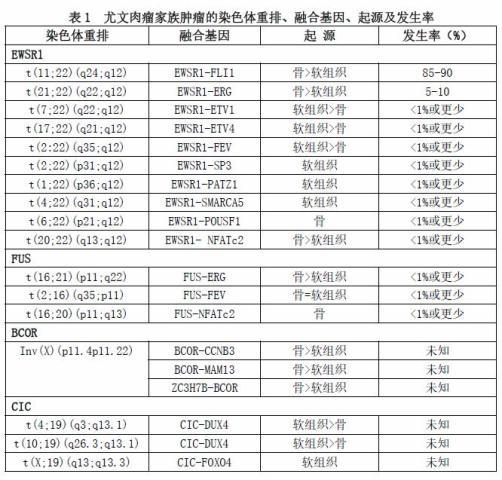
(1)EWSR1基因重排的尤文肉瘤
如前所述,尤文肉瘤中最早发现和最常见的遗传异常是t(11;22)(q24;q12)易位,导致EWSR1-FLI1基因融合,出现在85~90%的病例中;第二个最常见的遗传异常是t(21;22)(q22;q12)易位,导致EWSR1-ERG基因融合,出现在5~10%的病例中。在这2个最常见的重现性EWSR1基因易位(融合到FLI1或ERG)的尤文肉瘤病例中表现出很大的相似性,其中大多数发生在年龄较大的儿童,好发于骨,伴有强而弥漫的CD99膜阳性。在ETS家族的其他罕见成员中,相似的比较数据有限,总体上占所有尤文肉瘤的1%。除此之外,罕见的尤文肉瘤还包括EWSR1基因融合到非ETS的伙伴,包括锌指家族成员PATZ1(1P36)和SP3(2P31)、染色质重塑基因SMARCA5(4Q31)、与胚胎干细胞相关的转录因子POUSF1(6P21)以及一个与T细胞介导的转录因子NFATC2(20Q13)。在上述肿瘤中,很少有报告能提供明确的结论,但初步数据表明,非ETS组更可能表现出非典型特征,CD99呈阴性或仅有弱或灶状阳性。1例EWS-SP3基因融合的16岁男性患者,病变累及前额骨、肾脏和肺部,肿瘤细胞弱和局灶CD99阳性。1例39岁的女性为骨盆的未分化恶性原发性骨肿瘤,类似于尤因肉瘤,CD99阴性,但有EWSR1-POUSF1基因融合。1例EWSR1-PATZ1基因融合的16岁男性患者为胸部小圆细胞肿伴肺转移。免疫组化CD99阴性。1例1岁儿童患有骨骼外胸部肿瘤,具有t(1;22)(p36;q12)易位,CD99弱阳性[slight positive]。
除了尤文肉瘤,近几十年来发现EWSR1基因与多种骨和软组织肿瘤有关,其中大多数不是小圆蓝细胞肿瘤,如表2所示。
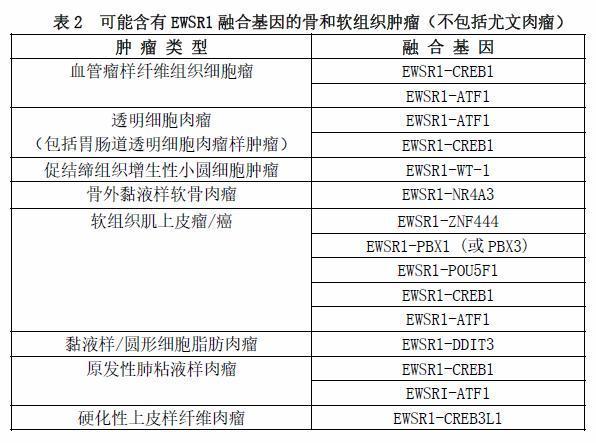
(2)FUS基因重排的尤文肉瘤
尤文肉瘤中另一个少见的基因是FUS,取代了EWSR1的作用,主要与常见的ERG(ETS转录因子)和不常见的FEV(ETS转录因子)基因发生融合。在文献报道的15例病例中,与FUS基因发生融合的有ERG(11例)、FEV(3例)和NFATC2基因(1例)。应该指出的是,EWSR1和FUS似乎在功能上是可互换的,属于相似的一组RNA结合蛋白。与常见的发生EWSR1基因重排的尤文肉瘤一样,那些具有FUS基因重排的肿瘤也常发生在大龄儿童,好发于女性,更容易累及骨骼。病理学特征表现为单一的小细胞形态和强弥漫性CD99膜染色。只有1例发生于15岁男性股骨的病例,具有FUS-NFATc2基因融合,没有CD99免疫染色的结果。
(3)CIC基因重排的尤文样肉瘤
与染色体19p13.2相关的Capicua transcriptional receptor(CIC)重排是罕见的,但在非EWSR1-尤文样肉瘤中是最常见的遗传学异常。据我们所知,第1例CIC重排圆细胞肉瘤是在1996年发现的。该患者为12岁男性,表现为脚踝肿块并肺转移,具有t(4;19) (q35;q13.1)易位。直到2006年,Kawamura-Saito等人才在2名成人患者中确认了CIC是和Dux4(双同源盒4)基因发生融合。CIC-DUX4融合由常见的t(4;19(q35;q13) 或少见的t (10;19) (q26;q13)引起,后者更具体地涉及DUX4 同源体DUX4L[Paralog DUX4L]。然而,在这种基因融合中,CIC偶尔与未知的伴侣基因发生融合(无DUX4或FOXO4基因异常),少数病例可为端粒缺失的非平衡性CIC基因重排,这促使人们使用术语“CIC重排肿瘤家族”[CIC-rearranged family of tumors]。最近记录的一个更常见的伙伴基因是FoxO4(Xq13)。这种肿瘤虽然仅见于少数病例,但与常见的CIC-DUX4重排肿瘤基本相似。在迄今为止最大的病例报道中,Antonescu等人评估了115例CIC重排的小圆蓝细胞肿瘤的临床病理学特征。CIC基因重排的尤文样肉瘤主要发生于儿童和年轻成人,平均年龄32岁,男性稍微多见,发病部位主要为深部软组织,极少数发生于骨。该病5年生存率明显比EWSR1重排的尤文氏肉瘤低。显微镜下表现为小至中等大小肿瘤细胞呈弥漫或结节状分布,瘤细胞之间为纤维性间隔。高倍镜下胞界不清,核呈圆形或卵圆形,核深染或染色质空泡状,可见核仁,核分裂象为6~99个/10HPF,平均为32个/10HPF。部分病例可见混杂的短梭形或胖梭形瘤细胞区域,或上皮样/横纹肌样细胞形态。间质可黏液样变性,大部分病例可见大片地图状坏死。肿瘤细胞DUX4核弥漫强阳性,可高达92%的病例表达WT1核阳性(多弥漫阳性),CD99表达不定(不到1/4病例弥漫阳性,约20%病例阴性),极少数病例CK和Desmin局灶阳性。
(4)BCOR基因重排的尤文样肉瘤
2012年,Pierron等人发现了一种新的小圆细胞骨肉瘤的“亚型”,这种小圆形细胞骨肉瘤具有BCOR(Bcl-6 interacting corepressor)和CCNB3(cyclin B3)的重现性基因融合。BCOR最常见的伙伴基因是CCNB3。BCOR-CCNB3基因融合的尤文样肉瘤主要发生于儿童和年轻成人,以男性多见,好发部位为骨和深部软组织。显微镜下可观察到类似于尤文肉瘤、经典的肾透明细胞肉瘤形态学,有些病例可呈血管周细胞瘤样改变。肿瘤细胞可呈圆形、短梭形,局部可呈漩涡状排列;卵圆形、短梭形细胞呈实性片状排列;肿瘤组织中可见纤细的毛细血管结构;可见出现坏死和局部间质纤维化。肿瘤细胞弥漫核强阳表达CCNB3、TLE1、cyclinD1和BCOR,CD99胞质或核旁阳性,WT1阴性。需要注意的是,如果肿瘤CCNB3胞质阳性,则不是BCOR-CCNB3基因融合的未分化肉瘤。部分病例可表达CD56、bcl-2和CD117。应与尤文肉瘤(CCNB3阴性)、肾透明细胞肉瘤(瘤细胞波形蛋白、cyclinD1和Bcl-2阳性,100%(8/8)BCOR核阳性)和差分化滑膜肉瘤(TLE1阳性,CCNB3和WT1阴性)等进行鉴别。BCOR除了与CCNB3基因发生融合外,还可与MAML3或ZC3H7B基因发生融合,发病年龄稍微较大。组织形态学与低分化滑膜肉瘤有一定的重叠,常表现为卵圆形和梭形细胞混合呈片状分布。瘤细胞BCOR弥漫的核强阳性,CD99强膜阳性,WT1阴性。有2例BCOR基因重排肉瘤显示恶性骨肉瘤样,因此该病需与小细胞骨肉瘤进行鉴别。这似乎有点复杂,因为大多数BCOR相关肉瘤(75%)强烈表达SATB2,而该标记通常被认为是成骨细胞分化标志物。
小细胞骨肉瘤
1979年,sim等人首次将发生于骨的小细胞骨肉瘤定义为一种独特的临床病理实体,称之为“具有类似于尤文肿瘤的小细胞骨肉瘤”。在梅奥诊所,从1000例连续骨肉瘤和300例连续尤文肉瘤中挑选出12例(除了12例咨询病例)符合上述标准的病例。12例肿瘤都含有“粉红色基质”,被认为是“骨样基质”,位于小圆形到椭圆形肿瘤细胞之间,不像尤文肉瘤中看到的那样一致[uniform]。偶尔观察到局灶的梭形细胞。检测的11例患者中PAS染色均为阴性。然而,作者认为尤文肉瘤的诊断是成立的,即使PAS染色是阴性。区分尤文肉瘤和小细胞骨肉瘤最重要的原因是因为治疗。对尤文肿瘤而言,手术切除是必要的,而不是放疗。虽然放射敏感性的概念在历史上被用作诊断尤文肉瘤的一个要素,但放射敏感性差也是支持小细胞骨肉瘤确实不同于尤文肉瘤的观点。我们应该指出,在上述资料发表之前,Jacobson记录了37例他统称为“多发性组织瘤”[polyhistioma]的病例,这些病例主要包括间叶性软骨肉瘤,但也有一些可能称为小细胞骨肉瘤更好的病例。事实上,他承认“许多小细胞骨肉瘤非常像这种病例。”1997年,Nakajima等人试图确定区分小细胞骨肉瘤和尤文肉瘤的临床和治疗重要性。对72例患者(45例有治疗和随访数据)的分析结果表明,小细胞骨肉瘤(5年生存率为28.5%)的预后明显低于经典型骨肉瘤(77%)和尤文肉瘤(50%)。然而,在最近的病例报道中,发现那些自1975年以来并受益于新辅助化疗的病例,小细胞骨肉瘤的5年累积生存率为68.6%。关于鉴别诊断,作者们说只有在肿瘤内发现骨样基质生成,小细胞骨肉瘤的诊断就是成立的。从分子角度来看,大多数小细胞骨肉瘤含有复杂的核型,没有重现性的结构异常或染色体易位。据我们所知的文献报道,有6例小细胞骨肉瘤含有t(11;22) (q24;q12) 核型和/或EWSR1重排的。如前所述,有2例报道称BCOR基因重排的肉瘤具有骨样基质。这些病例是否应归类为小细胞骨肉瘤尚不清楚。Righi等人最近分析了36例小细胞骨肉瘤的临床病理特征。所有病例均表现为SATB2强阳性和CD99阴性(我们应该指出,其他文献有发现CD99胞质阳性在小细胞骨肉瘤中相对常见,偶尔有弥漫膜阳性出现)。对10例检测EWS-FLI1、EWS-ERG和CIC-DUX4融合基因,均为阴性(PCR法)。作者认为,以前文献中记载的具有EWSR1基因重排的小细胞骨肉瘤,无论这些肿瘤是否产生骨样基质,都应认为是尤文肉瘤。然而,这种说法需要我们重新评估“骨肉瘤”的定义。大多数人仍然认为诊断小细胞骨肉瘤是需要有与小圆蓝细胞恶性肿瘤密切相关的骨样基质产生。小细胞骨肉瘤也有可能是一个“垃圾桶”,包括与类骨生成有关的所有小细胞肿瘤,大多数缺乏重现性的分子事件,但少数肿瘤具有EWSR1或BCOR基因重排。正如预期的那样,后者应如何治疗也不清楚。
间叶性软骨肉瘤
间叶性软骨肉瘤于1959年由Lichtenstein和Bernstein首次描述,这2例病例(发生于26岁男性的椎骨和22岁女性的顶骨)的形态学表现为“肿瘤由致密的、丰富的细胞和原始的短粗梭形细胞基质组成,部分区域表现出软骨样分化。”两名患者都出现了广泛的骨骼转移,最终死于疾病。Dahlin和Henderson于1961年对10例(上颌和肋骨各2例,跖骨、颈椎、肩胛骨、髂骨、脑膜和起源不明各1例)间叶性软骨肉瘤进行了观察,其中6例患者年龄为30~40岁,虽然8名患者死亡,但临床进展不同,从治疗到死亡的间隔时间为5个月~25年。组织学上,细胞丰富区主要由“轻微到明显的梭形”的小细胞组成,核分裂象多少不等,具有特征性的病变是多少不等的明显或不明显的软骨样病灶和未分化的小细胞。梅奥诊所在1971年用30个新病例进一步扩展了他们的数据(使文献中的总数达到51例,其中17例是纯软组织病例),有超过半数肿瘤患者的年龄为20~30岁,肋骨和颌骨是最好发部位。多数病例至少出现局灶血管外皮瘤样改变。在生存率和治疗反应方面,不同发病部位(骨和软组织)之间没有差异。如前所述,Jacobson最初试图将间叶性软骨肉瘤(和一些小细胞骨肉瘤的病例)包括在“多发性组织瘤”[polyhistioma]的名称下,他认为“间叶性软骨肉瘤”一词是“不合适的”,因为软骨分化并不总是发生,而且尚未证实原始细胞是间叶细胞。但到1977年Jacobson的文章发表时,“间叶性软骨肉瘤”这个术语已经根深蒂固,因此在文献中被普遍接受。
软骨样基质的存在是区分间叶性软骨肉瘤和尤文肉瘤的主要形态学要素,特别是在小活检标本中。如果没有,就很难区分这两个疾病。更复杂的是,大多数间叶性软骨肉瘤弥漫表达CD99,通常是膜阳性。早期的细胞遗传学研究未能确定一个重现性的核型。直到最近,最常见的细胞遗传学异常是涉及13和21号染色体罗伯逊易位。至少有1例含有经典型尤文肉瘤t(11;22)的报道。然而,还不清楚融合基因(如EWSR1-FLI1)是否也相似。现在我们知道大多数间叶性软骨肉瘤含有一种相对特异的基因融合HEY1-NCOA2。由于HEY1(8q21.1)和NCOA2(8q13.3)基因在8号染色体上相隔仅10MB,传统的细胞遗传学很难发现。虽然融合基因的鉴定主要依赖于对先前存在的染色体结构变化的识别,但是利用一种新的“全基因组”筛选的外显子表达数据证实了HEY1-NCOA2基因融合。现在可以证实间叶性软骨肉瘤是一种具有独特临床病理学特征的病种。
促结缔组织增生性小圆细胞肿瘤
Gerald和Rosai最初描述的“具有异向分化[divergent differentiation]的促结缔组织增生性小细胞肿瘤”在1989年被“促结缔组织增生性小圆细胞肿瘤”这个术语取代。Sesternhen等人在1987年首次在17名年轻男性患者中描述了涉及骨盆或阴囊的肿瘤。高度恶性的小圆细胞肿瘤通常累及大龄儿童和成人,最常见于腹腔,包括附睾、胸膜和骨等部位也有报道。病理学特点是巢状和束状小圆细胞被成纤维基质分隔并表现出多种免疫表型(包括神经、肌源性和上皮标记物)。很少促结缔组织增生性小圆细胞肿瘤表达CD99,但WT1(羧基端)通常阳性。该肿瘤侵袭性高,多次局部复发,大多数患者于2~3年内死于该疾病。1992年首次发现该肿瘤大部分病例存在t(11;22)(p13;q11.2)易位导致EWSR1-WT1基因融合。然而,在尤文肉瘤和促结缔组织增生性小圆细胞肿瘤之间,仍有少数发生于腹部的促结缔组织增生性小圆细胞肿瘤表现出明显的“混合”[hybrid]特征,表现为促结缔组织增生性小圆细胞肿瘤的形态特征和免疫表型。显示EWS-FLI1和EWS-ERG基因融合的这两个例子都发生于年轻人,除了表达角蛋白、结蛋白和神经标记物外,瘤细胞CD99强阳性。然而,更多证据支持促结缔组织增生性小圆细胞肿瘤是一种具有独特临床病理学特征的病种。
治疗相关问题
我们在肉瘤分类和预后方面的持续进展有一个明显事实是,即使这些特征可能与预后相关,治疗也不能解释所有这些特定的临床病理学发现和差异。虽然我们有很多证据表明,尤文肉瘤家族中一些有争议的病例的生物学行为明显比其病例差,但大多数患者的治疗方案都是相似的,主要是基于临床分期。如间叶性软骨肉瘤没有特定的化疗方案,它们通常用尤文肉瘤或骨肉瘤的方案。BCOR基因重排肉瘤也是根据尤文肉瘤治疗指南进行治疗,与经典型尤文肉瘤一样,对化疗也很敏感。尽管有强有力的证据表明CIC基因重排肉瘤是一种比经典型尤文肉瘤预后更差的疾病,但大多数病例都是用尤文因肉瘤方案来进行治疗的。虽然尤文样肉瘤和类似的小圆蓝细胞肿瘤非常少见,积累足够的病例来进行有意义的治疗比较试验是非常困难的,但这并不意味着我们作为病理人的角色在试图将尤文肉瘤“家族”分类时是微不足道的,包括识别潜在的亚型和可能不同的病种。
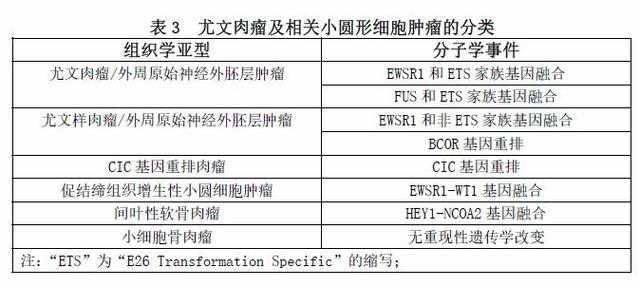
尤文肉瘤家族肿瘤的类型有哪些?
与具有独特的病种相比,应如何定义新的亚型/变异体?它是具有独特的病理形态、临床特征、发病人群、对特定疗法的反应,还是分子和遗传学特征?我们是否需要上述部分或全部特征?Ewing医生对尤文肉瘤的最初定义不仅包括可复制的形态,而且还要求预后差,对放射治疗有显著的反应。当然,我们现在有条件能够将不同的分子和细胞遗传学事件纳入到这个定义中。然而,有争议的是,单凭病理结果,无论是否有明显的遗传学特征,如没有独特的临床表现或治疗反应,都不足以定义一个新的病种。
我们尝试总结的尤文肉瘤家族和相关肿瘤的各种亚型或实体的定义见表3。值得怀疑的是,目前任何一个执业医师都不完全相信尤文肉瘤、PNET和Askin瘤是同一肿瘤的不同谱系,包括“尤文肉瘤”的名称。根据大量的证据,我们可以很好地得出结论,促结缔组织增生性小圆细胞肿瘤和间叶性软骨肉瘤是不同的临床病理实体,而不是尤文肉瘤家族的成员,尽管早期个别病例证实了存在具有尤文肉瘤的t(11;22)(q24;q12)核型。过去十年中的大多数文献都支持这一观点,绝大多数病例都显示了相对特定的遗传和分子学特征。促结缔组织增生性小圆细胞肿瘤和间叶性软骨肉瘤也有特定的好发人群和发病部位,可重复的组织学特征(除了是一个小圆形细胞肿瘤),临床预后(通常更差)与常说的尤文肉瘤完全不同。小细胞骨肉瘤的情况仍然复杂。有一些小细胞骨肉瘤表现为BCOR或EWSR1基因重排,尽管很少见,但后者可能是有“骨样形成”的尤文肉瘤。这类病例是否应归类为尤文肉瘤,目前尚不清楚,也存在争议。如果把透明变性的胶原或骨化生简单地误认为“恶性”骨样基质,那么这些病例被排除就是过于苛刻[hypercritical]和毫无根据的[unwarranted]。仅仅通过是否有EWSR1基因重排来定义一个尤文肉瘤可能太有限了,并且没有考虑到这个基因的混杂性,也没有考虑到有FUS基因重排的尤文肉瘤(或尤文样肉瘤)的病例,这些肿瘤在临床和病理学上大多数都无法区分。尽管有少数证据支持ETS家族型融合的尤文肉瘤与非ETS家族型融合的尤文肉瘤之间存在差异,但仍存在明显的临床病理重叠,很少有病例提供明确的结论。越来越多的证据表明CIC基因重排肉瘤不同于尤文肉瘤,但对于BCOR基因重排的小圆细胞肿瘤,类似的结论可能不充分,尽管其有更好临床结果的趋势。CD99局灶或片状阳性的染色模式使得我们更多的考虑为非EWSR1基因重排的尤文样肉瘤以及其他小圆蓝细胞肿瘤,包括间叶性软骨肉瘤和小细胞骨肉瘤。
全文完
【参考文献】Ewing Sarcoma and the History of Similar and Possibly Related Small Round Cell Tumors: From Whence Have We Come and Where are We Going?
我要评论






共0条评论