我的博文
前列腺基底细胞癌临床病理特征及文献复习
1前言
前列腺基底细胞癌(basal cell carcinoma,BCC)是一种由前列腺基底细胞构成的罕见的前列腺恶性肿瘤,由Frankel等于1974年首次报道,称其为腺样囊性癌,后被命名为基底样细胞癌、腺样囊性基底细胞癌、基底细胞癌等。WHO (2004)泌尿系统和男性生殖器官肿瘤分类中,基底细胞肿瘤包括基底细胞腺瘤和BCC,将细胞丰富结节性基底细胞增生称为基底细胞腺瘤,类似于基底细胞癌和腺样囊性癌的恶性基底细胞肿瘤则统称为BCC。2011年外科病理学将前列腺基底细胞样肿瘤分为两种①腺样基底细胞肿瘤:形态类似涎腺腺样囊性癌,生物学行为较温和;②BCC:形态类似于肛管基底细胞样癌,生物学行为高度恶性,此两种类型肿瘤免疫组化标记鉴别比较困难。在2016版WHO泌尿系统和男性生殖器官肿瘤分类中的基底细胞肿瘤删除基底细胞腺瘤,只保留BCC,并等同于腺样囊性癌。前列腺BCC罕见,目前国内文献相关报道较少。笔者现复习国内外相关文献,将其临床特征,病理形态学及免疫表型,临床治疗及预后,总结如下,望能提高该肿瘤的初步认识。
2临床特征
发生在前列腺BCC临床非常罕见,检索至今为止中外文献,报道仅有百余例,占前列腺癌比例不到0.01%。报道中发病年龄为28-89岁,中位年龄为68岁,其发病年龄较前列腺腺癌年轻,其临床症状与前列腺腺泡细胞癌相似,主要表现为尿路梗阻症状和血尿,可出现尿频、尿急、夜尿增多、尿痛、尿潴留或伴间歇性肉眼血尿等临床症状,直肠指诊发现前列腺增生质较硬,B超、CT和MRI与前列腺腺泡细胞癌相似,而血清PSA 浓度一般在正常范围内,成为临床上与前列腺腺泡细胞癌鉴别要点,但少数情况下也可出现血清PSA浓度轻度升高。正常情况由于血管壁屏障功能和间质纤维结缔组织阻隔作用,PSA物质由前列腺腺泡细胞产生,并分泌至导管内或腺泡腔中,当发生腺泡细胞癌时,分泌PSA物质也随之增多,且肿瘤细胞可破坏血管和间质阻隔屏障作用,造成PSA物质大量释放入血。前列腺BCC可与腺泡细胞癌伴发,引起血清中PSA浓度明显升高。
3病理学特征
大体检查 前列腺BCC大体呈结节状,切面呈灰白色, 部分可呈鱼肉样,界限不清,有时可见微囊形成,而普通前列腺腺癌通常为黄色,但肉眼很难与前列腺增生症区分。肿瘤主要位于前列腺的移行区,也有的位于外周区。前列腺BCC呈浸润性生长,肿瘤细胞常排列呈巢团状、假腺样或腺样囊性结构,由两型细胞组成,外围多是基底样细胞,也是肿瘤细胞主体成份,胞核呈圆形、卵圆形,胞浆稀少,嗜酸性或嗜碱性,最外层细胞常呈栅栏状排列;内层多是单层排列的立方或柱状导管上皮细胞,有中等量微嗜酸性的胞浆,染色质空泡状;瘤细胞可见核仁和核分裂像,核分裂像0-60个/10HPF,部分腺腔内或筛孔样结构内含嗜碱性粘液或嗜酸性蛋白物质,PAS染色可呈阳性,部分分化差癌巢内可见粉刺样坏死。文献认为恶性BCC病理诊断:①广泛浸润正常前列腺组织;②前列腺外侵犯;③神经周围侵犯;④肿瘤坏死,而血管浸润极为罕见。
前列腺BCC除最内侧腺腔样上皮外,大部分肿瘤细胞表达基底细胞标记物,如P63、34βE12、CK5/6等,目前认为p63是前列腺基底细胞特异性高及敏感性强标志物。Shah等认为p63对于基底细胞识别比CK(34βE12)敏感性更高,联合应用CK( 34βE12)及p63可提高检测结果稳定性并减少假阴性结果。腺腔最内侧上皮细胞CK7阳性而CK20阴性。肿瘤细胞弥漫强阳性表达BCL-2,主要表达在基底样细胞区,许多文献报道瘤细胞SMA及S-100蛋白阴性,表达在外围基底样细胞,部分病例HER-2可阳性,表达于癌巢腔内细胞,而外围细胞阴性,AR可出现核阳性,个别病例可出现CD56、SYN局部阳性,一般不表达P504s、PSA、PAP、CD117等,KI-67文献报道≥20%),BCL-2强阳性和ki-67指数增高有助于诊断。电镜下见瘤细胞内细胞器较少,在胞质内无成熟的肌丝等结构,表明瘤细胞为基底细胞而无肌上皮细胞分化。
结合文献资料总结其病理诊断主要依据如下:①临床患者主要表现为前列腺肿大及尿路梗阻症状,血液PSA一般不升高;②镜下见肿瘤细胞形态学类似于涎腺BCC,肿瘤细胞呈巢状、条索状及小梁状排列,其边缘瘤细胞呈栅栏状排列,有时可呈筛状排列,类似于腺样囊性癌;③肿瘤细胞可表达CK(34βE12)、p63 及 BCL-2 等,一般不表达P504s、PSA及PAP;④肿瘤可浸润前列腺间质、包膜,神经及膀胱壁等;⑤肿瘤内有坏死及广泛纤维化,此外有学者认为肿瘤核分裂象高及Ki-67 殖指数较高也支持BCC诊断。
4组织学来源
正常的前列腺腺体由具有分泌功能腺上皮细胞、基底细胞和神经内分泌细胞三种细胞组成,基底细胞数量最少仅占10%左右,无分泌功能,是一种未分化多潜能分化细胞,富含角质索,可发生从基底细胞增生到基底细胞癌一系列增殖性病变。有研究证实前列腺基底细胞有两种不同来源: 一种来自前列腺管泡腺基底细胞,34βE12、PSA、P63、PAP免疫组化染色均呈强阳性,组织学上可呈腺样、实体和筛状构型;另一种来自前列腺尿道或大导管移行上皮基底细胞,34βE12、P63呈强阳性而PSA、PAP阴性,组织学上同样呈腺样、实体和筛状构型,但细胞巢常呈鳞状上皮化生,巢周边细胞呈栅状排列,且常可发现这一病变靠近前列腺部尿道移行上皮,并与其基底细胞增生密切相关。
5鉴别诊断
前列腺基底细胞癌临床非常罕见,需要与以下疾病鉴别。包括基底细胞增生、前列腺腺泡细胞癌、尿路上皮癌、神经内分泌癌等。
①前列腺基底细胞增生:通常细胞巢较小,常以呈实体巢或筛状样结构为主,或二者混合形态,基本保留增生前腺体形态结构,增生细胞巢与周围组织边界圆滑,细胞大小形态较一致,染色质均匀,比正常基底细胞略大,细胞质较丰富,核呈卵圆形,形态温和,核仁小或不明显,未见明显异型性及核分裂象,部分病例可伴有鳞状上皮化生,无脉管及神经侵犯、坏死和间质纤维增生。而前列腺BCC排列方式可呈腺样囊性结构、大实巢状或小腺腔样结构,当实性细胞巢较大时,通常可伴有坏死,肿瘤细胞与周围间质界限不清,呈浸润性生长,细胞核深染,伴明显异型性,易见核分裂,可见间质神经束的侵犯和平滑肌的浸润,细胞外侧基底膜样物质的沉积也是基底细胞癌的特征之一,有助于与基底细胞增生进行鉴别。免疫组化BCL-2 弥漫性强阳性表达,和 Ki-67 表达率增高,也有助于与前者鉴别。
②前列腺筛状癌: 临床上患者血清中 PSA 水平通常显著升高,镜下瘤细胞核仁明显,无栅栏状排列方式,筛孔内未见明显粘液分泌,免疫组化表达PAP、PSA 和 P504s,不表达CK( 34βE12)及 p63。前列腺基底细胞癌患者血清中PSA水平一般不升高或偶尔轻度升高,瘤细胞较小,核仁不明显,癌巢外围细胞常呈栅栏状排列,免疫组织化学染色标记物 CK ( 34βE12)、 p63 阳性, 而 PAP、 PSA 及P504s 常阴性。
③低分化尿路上皮癌侵犯前列腺:一种从临床方面区别无发现尿路肿瘤,另一种从组织学方面。差分化尿路上皮癌显微镜下可呈实性巢状浸润性生长,但是细胞异型性显著,核分裂像多见,肿瘤细胞胞浆较丰富,可伴有鳞状上皮或腺上皮化生,免疫组化标记CK7、CK20、GATA3阳性,而基底细胞癌阴性,经广泛取材,一般可以找到分化较好尿路上皮癌区域,有助于二者鉴别,另外结合膀胱镜检查结果,对于二者的鉴别有提示作用。
④低分化鳞状细胞癌,原发的可能起源与前列腺尿道上皮、尿道周前列腺导管移行上皮、前列腺腺泡的基底细胞或前列腺的多潜能干细胞,其免疫抗体标记和基底细胞有部分交叉,但是鳞状细胞癌具有的组织学特点,如癌组织内见有角化珠形成、细胞间有间桥。
⑤前列腺低分化腺泡细胞癌:患者主要为老人,血液中PSA常明显升高,瘤细胞核仁常较明显,无栅栏状排列,表达PAP、PSA及P504s,而不表达CK(34βE12)及p63。前列腺BCC患者可为中青年人,血液中PSA一般不升高,瘤细胞较小,异型性及核仁不明显,在瘤细胞巢及小梁周围的瘤细胞常呈栅栏状排列,免疫组化标记瘤细胞CK(34βE12)及p63阳性,而PAP、PSA及P504s常阴性。
⑥前列腺导管癌:肿瘤细胞常呈柱状,胞质丰富,细胞核异型性较明显,瘤细胞可形成腺样结构及具有明显分支乳头状结构,瘤细胞表达PAP及PSA,不表达CK(34βE12)及p63。前列腺BCC肿瘤细胞较小,呈圆形、立方形及卵圆形,胞核异型性较轻微,在瘤细胞巢及小梁周围肿瘤细胞常呈栅栏状排列而不形成具有明显纤维结缔组织轴心乳头状结构,肿瘤细胞 CK(34βE12)及p63阳性而PAP及PSA 阴性。
6 临床治疗和预后
前列腺BCC临床罕见,目前对其恶性程度及生物学行为有不同意见, 一般认为 Gleason 分级不适用于前列腺BCC。许多学者认为前列腺BCC病程进展呈惰性, 低度恶性肿瘤呈慢性发展过程。也有学者提出包含基底细胞形态较多的病例较包含腺样囊性结构多的病例,临床预后稍差。对于肿瘤治疗方法目前也无统一方案,手术方式多采用耻骨后前列腺根治切除术或者采取前列腺电切手术方式,也有学者提出对于复发和转移的患者可采用激素治疗,但并无大宗病例报告关于采取去势治疗及抗雄激素治疗对临床预后影响。晚期或者转移的病例建议使用内分泌治疗。但有学者认为,由于前列腺基底细胞癌是非分泌细胞肿瘤,去势治疗可能无效。
Iczkowski 等报道19例前列腺BCC中5例肿瘤浸润至前列腺包膜外,3例肿瘤浸润至膀胱,4 例肿瘤发生转移,4例伴发前列腺腺癌。15例随访结果2例患者分别于诊断后1.5 年及3年死亡,表明肿瘤的侵袭性较强,恶性程度较高。 与一般的前列腺腺癌常转移至骨组织不同,肝脏、肺以及直肠是前列腺基底细胞癌常转移的部位。同时伴发前列腺腺癌时,肿瘤侵袭和转移能力均增强。
7基底细胞增生
正常前列腺基底细胞是前列腺固有腺体中在分泌上皮和基底膜间单层排列的一层细胞,胞核小,胞质稀少,呈梭形或卵圆形,正常时不明显。前列腺基底细胞病变包括普通型基底细胞增生(basal cell hyeprplasia,BCH)、BCH伴红色样变、非典型性BCH、BCC。BCH常与前列腺增生伴发,呈多灶状散在于前列腺间质中。BCH是前列腺BCC癌前病变,基底细胞异常增生发展到结节性增生,此时基底细胞核增大,呈腺样、实性巢状排列,胞浆增多,可见核仁,之后又发生基底细胞恶性损伤,发展成BCC,这种形态学连续性变化,也同样可发生在皮肤和唾液腺等。
BCH组织学上分为2种亚型,一种是小腺体呈灶状分布在前列腺增生中,另一种是由腺体形成的腺样间质结节。基底细胞可围绕腺泡周围增生呈多层腺样,也可偏于腺泡一侧扁平增厚或呈片状增生,或增生呈实性小细胞巢,几种结构常混合存在。肖立等报道前列腺BCH主要以巢状和腺样结构为主,或二者混合,部分病例出现鳞化,少量病例亦可同时伴有筛状结构。BCH分为完全性、不完全性、非典型性、腺样囊性和萎缩相关性。BCH多呈实性巢状,也可表现为囊腺样增生形式。增生实性巢中央若无腺上皮为完全性BCH,若巢中央衬有腺上皮则为不完全性BCH。这种分类只是形态上差异,便于识别,二者均为经典BCH模式。不典型BCH特征是出现明显核仁,胞核增大,染色质丰富,细胞有轻中度异形性,可见坏死性腔内分泌和不成熟鳞状化生。BCH在诊断时根据肿瘤组织学结构特点及免疫组织化学染色确定组织来源,根据细胞异型性和浸润特点,即可与BCC鉴别。此外还要与上皮内瘤变、前列腺癌及尿路上皮癌累及前列腺等鉴别。
鉴别诊断:①BCH与BCC鉴别:(参照前文,不做赘述)。②BCH与筛状高级别上皮内瘤变和前列腺筛状癌鉴别:前列腺上皮内瘤变常除有筛状结构外,腺上皮增生还会出现微乳头和驼峰样等结构。前列腺筛状癌分级为Gleason4级,除筛状结构外会同时出现浸润性单层排列小腺体。而筛状BCH周围会有细胞排列整齐实性小细胞巢,无异型性。免疫组化对鉴别诊断起重要作用。
8小结
前列腺BCC在临床上罕见,目前文献报道较少,临床表现无特异性,血清PSA多不升高,病理形态学类似于腺样囊性癌,目前认为BCH为其癌前病变,目前认为其为惰性生物学行为,但也有转移病例报道,术后需密切随访。因此其肿瘤生物学行为、治疗方案及预后评估有待进一步深入研究探讨。
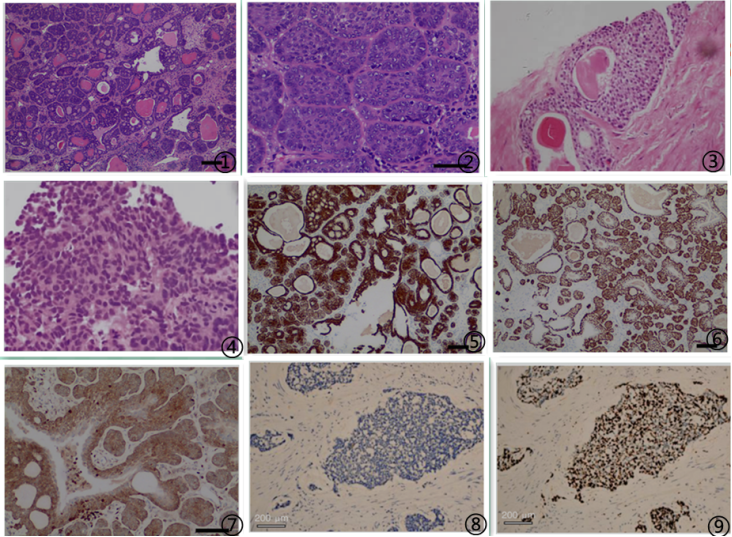
图1 肿瘤细胞排列呈腺样囊性结构,腔内含嗜酸性或嗜碱性分泌物;图2 肿瘤细胞呈实巢状排列,巢外围细胞呈栅栏状排列;图3 基底细胞增生2层或多层,胞浆丰富透亮,基底细胞环绕腺上皮多层增生,局部筛孔状,图4 基底细胞癌低倍呈不规则实性细胞巢,细胞大小不一,核浆比大,异型明显;图5 CK5/6示大部分肿瘤细胞阳性表达,少量内层分泌样上皮细胞阴性;图6 P63示大部分肿瘤细胞阳性表达,少量内层分泌样上皮细胞阴性;图7 BCL-2示大部分肿瘤细胞阳性表达,少量内层分泌样上皮细胞阴性;图8 肿瘤细胞PAS阴性;图9 肿瘤细胞增殖指数较高,约40%。图片来自于参考文献,如有侵权,请联系删除。
参考文献:
[1]K,Frankel,J R,Craig.Adenoid cystic carcinoma of the prostate. Report of a case.[J].American journal of clinical pathology,1974,62(5): 639-45.DOI:10.1093 /ajcp/62.5.639.
[2]申发燕,白冬雨,张海萍,钟山,庄严阵.前列腺基底细胞癌临床病理特征及文献复习[J].中国组织化学与细胞化学杂志,2020,29(01):56-60.
[3]王承军,刘嘉祺,刘祖宏.前列腺基底细胞癌1例及文献复习[J].新疆医学,2017,47(07): 798-799.
[4]藏素红,张静,石怀银,吴彦,罗丹,张亚静.前列腺基底细胞增生和基底细胞癌的诊断与鉴别诊断[J].新疆医科大学学报,2013,36(10):1434-1436+1441.
[5]李学超,吴世奎,詹钰,董金凯,麦海星,曲楠,陈立军.前列腺基底细胞癌1例临床分析并文献复习[J].微创泌尿外科杂志,2019,8(02):141-144.
[6]张怀念,蔡宇翔.阴茎转移性前列腺基底细胞癌1例[J].临床泌尿外科杂志,2020,35 (02) :167-168.
[7]王瑜,郭鹏,刘清松,谢孝川,谷从阳,敬敏,刘贵平.前列腺基底细胞癌5例临床病理特征分析并文献复习[J].中华男科学杂志,2014,20(02):160-164.
我要评论





共0条评论