我的博文
聚焦:癌症免疫疗法全攻略
来源:生物通
简介:
高通量测序技术促进了癌症和免疫学的研究,以及个体化免疫治疗的发展,比如说,高通量测序极大地促进了我们对癌症基因组,肿瘤发生过程中细胞内机制的了解,而且癌症基因组分析还揭示了免疫系统能靶向的抗原表位。同时测序也可以用于确定免疫组库,实时,高敏感地监控对肿瘤生长或治疗产生应答的克隆扩增和细胞群体浓度。
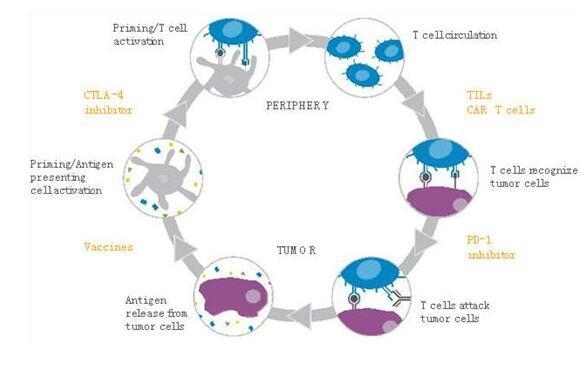
(T细胞介导的免疫功能:要构建一个成功的免疫应答,需要许多步骤。肿瘤特异性抗原来自死亡肿瘤细胞。新抗原(neoantigens)是肿瘤中的突变多肽,在正常组织中是不存在的,其通过抗原提呈细胞识别,而后提交给T细胞,在经过免疫检查点的时候激活T细胞。这些激活了的T细胞散布在血液系统中,当肿瘤被识别出来时,在系统T细胞应答建立之前必须经过其他检查点。图上橙色的文字指示的是发表论文中出现过的免疫调节治疗方法。)
疫苗免疫疗法(VACCINE IMMUNOTHERAPY)
Carreno BM, Magrini V, Becker-Hapak M, et al. Cancer immunotherapy. A dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen-specif c T cells. Science. 2015;348 (6236):803-808.
这篇Science论文报道了三位患者免疫反应的相关数据。如果在更多患者中进行测试的结果证实疫苗是有效的,它们或许有一天会被拿来给予手术后的患者,刺激他们的免疫系统攻击残留的癌细胞及防止癌症复发。
Diken M, Kreiter S, Kloke B, et al. Current developments in actively personalized cancer vaccination with a focus on RNA as the drug format. Prog Tumor Res. 2015;42:44-54.
测序技术能帮助研究人员快速获取癌症患者的基因组特征和转录数据,揭示高度癌症特定变异。这是个性化医疗,以及癌症诊断的一大突破,这也为个体化医疗带来了希望。
癌细胞蛋白序列中的一些突变可以为研究人员提供免疫系统识别抗原的宝贵来源,用于开发疫苗。在多种可能的癌症疫苗形式中,以mRNA为基础,由于变异抗原表位编码的疫苗已经得到了可喜的成果,并且被证明具有临床前和临床安全性。
过继细胞疗法(ADOPTIVE CELL TRANSFER)
Chimeric Antigen Receptor (CAR) T Cells
Morrison C. CAR-T f eld booms as next-generation platforms attract big players. Nat Biotechnol. 2015(6);33:571-572.
CAR-T细胞疗法是过继性免疫细胞治疗的一种,包括体外对T细胞修饰使其能靶向肿瘤抗原并产生相应免疫反应。CAR-T细胞治疗在CD19阳性白血病的早期治疗效果极其显著,使得市场对该领域开拓者Kite、Juno公司和最早做出巨资投资的Novartis公司超高估值。
Kalos M, Levine BL, Porter DL, et al. T cells with chimeric antigen receptors have potent anti-tumor effects and can establish memory in patients with advanced leukemia. Sci Transl Med. 2011;3(95):95ra73.
嵌合抗原受体(CAR)T细胞技术是近年来备受关注的一种癌症免疫疗法。CAR插入T细胞之后,能赋予它们靶标肿瘤细胞的能力,进而启动一系列抗癌免疫应答。CAR包括一个抗原识别区域,能够识别肿瘤细胞表面的特异性蛋白;还包括一个细胞内区域,能够激活T细胞并促进其增殖。
CAR T细胞已被证明可以治疗多种抵抗化疗的白血病,但这些细胞也可能引起严重的副作用,甚至有患者因此而死亡。
TIL(肿瘤浸润淋巴细胞)
肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)是指那些离开血流进入到肿瘤中的白细胞。当存在大量的肿瘤浸润淋巴细胞时,表明机体启动了对抗肿瘤的免疫反应。在许多的癌症中,研究人员均开展了相关的研究,定量这些肿瘤浸润细胞,并将其数量与肿瘤特征和结果关联起来。
Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 2015;348(6230):62-68.
2013年,Rosenberg领导的团队率先采用外显子测序技术,鉴别在患者中表达的突变蛋白,并用一种 MHC分子-抗原表位亲和力算法进行模拟预测评估,进而合成候选的抗原表位,开展免疫反应验证。通过此方法,研究人员能快速鉴别出了在患者肿瘤 细胞上表达,能被肿瘤浸润淋巴细胞(TIL)识别的突变抗原。
2014 年,Rosenberg团队将该方法成功应用到临床,他们通过高深度外显子测序技术、免疫反应功能验证,筛选出一位转移性胆管癌患者的高频突变基因,并鉴定到其对应的TIL克隆,通过大量扩增该TIL克隆 并实施回输治疗,使患者的病情得到有效控制。 2014年底,另一个研究团队联合应用外显子测序技术、转录组测序技术、高通量蛋白质谱分析技术,及 MHC分子-抗原表位亲和力模拟预测技术,寻找到 能被T细胞识别从而高效激活免疫反应的多肽疫 苗,该个性化肿瘤疫苗兼具预防性疫苗与治疗性疫苗的效能。这篇综述主要介绍了其中相关的内容。
免疫检查点阻断(Checkpoint Inhibitors)
免疫检查点阻断(immune chenkpoint therapy)癌症疗法是一类通过调节T细胞活性来提高抗肿瘤免疫反应的治疗方法。
Sharma P, Allison JP. The future of immune checkpoint therapy. Science. 2015;348(6230):56-61.
目前,免疫检查点阻断疗法已经加入了由手术,放疗,化疗,靶向治疗等组成的"抗癌大军"中。由FDA批准的三种免疫疗法药物中,一种是特异性结合T细胞表面CTLA-4受体的抗体类药物,叫做ipilimumab,于2011年得到批准。另外两种是特异性结合T细胞表面PD-1受体的抗体类药物,分别叫做pembrolizumab与nivolumab,于2014年得到批准。
以上这几种药物并不直接作用于肿瘤细胞,而是通过作用于T细胞类间接杀伤肿瘤细胞;另外,它们并不是针对肿瘤表面的某些特定物质,而是系统性地增强了全身的抗肿瘤免疫反应。具体来讲,在一小部分特定的癌症类型中,CTLA-4抗体类药物已经能够有效延长患者寿命长达十年。
Sharma P, Allison JP. Immune checkpoint targeting in cancer therapy: toward combination strategies with curative potential. Cell. 2015;161(2):205-214.
在过去30年里研究者已经阐明了许多参与癌症发生的分子机制,而同时研究者也鉴别出了许多可以诱发癌症的遗传突变,而针对这些致癌的遗传缺陷的靶向药物被证明在很多患者的初期治疗中是有作用的,然而耐药性随之而来,因为肿瘤拥有多种基因组缺失,其就可以帮助肿瘤细胞在药物疗法后产生一种耐药性。
来自德克萨斯大学MD安德森癌症中心的研究人员通过研究表示,利用免于免疫系统攻击癌症的药物同基因组靶向疗法相结合或许可以更好地帮助治疗癌症患者。
微生物的作用
芝加哥大学的研究人员通过将一种特殊的细菌导入到黑色素瘤小鼠的消化道中,提高了小鼠免疫系统攻击肿瘤细胞的能力。这一效益与采用抗PD-L1抗体一类的检查点抑制剂进行治疗相差无几。
研究人员在Science杂志上报告称,联合给予口服剂量的细菌及注射抗PD-L1抗体几乎完全消除了肿瘤生长物。
我要评论






共0条评论