我的博文
通路 | 健康守护神:RIG-I信号通路介导的自身免疫反应二三事
小编在上次的NF-κB信号通路专题中介绍说,今后与免疫治疗相关的研究会很火。今天,本着打铁需趁热的精神,我再来跟大家唠唠细胞信号介导的先天免疫应答过程。当然,小编想到要谈论这个话题,也是由于如下契机。近日,国际学术杂志The EMBO Journal在线刊载了中科院上海生科院生化细胞所周兆才老师与黄超兰老师课题组合作的最新研究成果——RIG-I信号通路在抗病毒免疫反应中的新型负调控机制。大家可能对RIG-I样受体比较陌生,其实它是机体抗病毒免疫作用发挥过程中一类重要的模式识别受体(pattern-recognitionreceptors, PRRs)。这个家族中除了RIG-I外,最有名、大家最熟悉的成员是Toll样受体(Toll like receptors, TLRs)。其他还包括NOD样受体(NOD like receptors, NLRs)、Hin-200家族蛋白和一些DNA受体。
想必大家都或多或少知道,包括病毒在内的多种病原体能够触发细胞先天性免疫应答,这种免疫应答对限制病原体的早期扩散是必不可少的。若是病原体不能被快速消灭、清除,就有形成慢性炎性的危险。结合我上次在NF-κB信号通路中介绍的知识点,慢性炎症可是会大大增加细胞癌变的可能。具体来说,病毒感染机体后,有效的抗病毒天然免疫作用的发展需要强健的特异性免疫系统的活化。这一过程依赖于宿主细胞快速感知病毒的能力,然后对正常细胞和免疫细胞发出预警信号。细胞内的这种信号传递,就依赖于我们在上文中提到的RIG-I样受体和Toll样受体等特定的模式识别受体。

接下来,我们首先简单回顾下经典的RIG-I受体介导的信号传导机制:
视黄酸诱导基因蛋白I(RIG-I)受体包含一个特殊的DexD/H框RNA解螺旋酶结构域,可识别、结合病毒RNA,它具有ATP酶活性,可使RNA构象发生改变并激活下游信号的转导。RIG-I具有一个特殊的caspase活化和招募结构域CARD,该结构域协助RIG-I与下游接头分子MAVS结合,导致干扰素调节因子IRF-3、IRF-7的活化和NF-κB进入细胞核。这一过程最终导致干扰素、干扰素促进因子和促炎因子等各种抗病毒基因的活化,从而抑制病毒的复制和传播。细胞中的RIG-I活化受到严格控制,当没有病毒RNA刺激时,位于RIG-I蛋白C端的抑制结构域使RIG-I处于非活化状态。而且,当入侵的病毒被清除后,机体又会开启针对RIG-I的负调控机制。主要通过E3泛素酶RNF125将K48泛素结合到RIG-I上,诱导它被蛋白酶体降解。
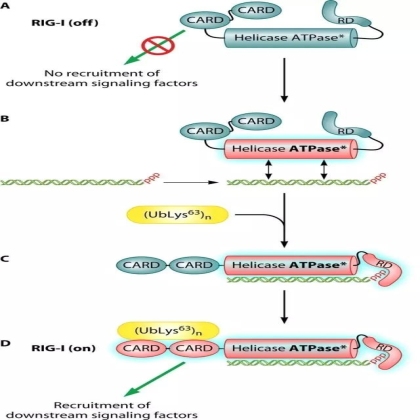
RGI-I信号通路介导抗病毒免疫反应的开启和关闭
图片来源: Gerlier, D. and D.S. Lyles, Interplaybetween Innate Immunity and Negative-Strand RNA Viruses: towards a RationalModel. Microbiol Mol Biol Rev. 2011. 75(3): p. 468-490.
而周老师课题组研究成果的核心内容是发现一种p97复合物能够负调控RIG-I-MAVS介导的抗病毒免疫反应,抑制I型干扰素的产生。接下来,小编为大家简单梳理下本文的主要研究内容:
在p97众多的辅因子中,找到了参与p97负调控抗病毒信号传递的辅因子Npl4,并解析了高分辨p97-Npl4复合物的晶体结构,从原子水平证实它们的相互作用;
p97-Npl4复合物促进K48泛素介导的RIG-I受体泛素化降解;
E3泛素化连接酶RNF125是介导p97-Npl4复合物抗病毒信号抑制过程的关键;
RNF125/p97-Npl4复合体介导的RIG-I泛素化过程中,最关键的残基是第181位赖氨酸,同时此泛素化过程受K172和K170翻译后修饰的调控;
病毒入侵导致的RIG-I构象变化使CARDs结构域暴露并发生K63泛素化,进而增强RIG-I与p97-Npl4复合物的相互作用。
本文还解析了p97-Npl4复合物与p97抑制剂DBeQ和NMS-873相互作用的高分辨晶体结构,从原子水平展示了抑制剂影响p97蛋白ATP酶活性的机理,随后的动物试验也证实这两种小分子化合物能够增强小鼠抗病毒免疫反应。
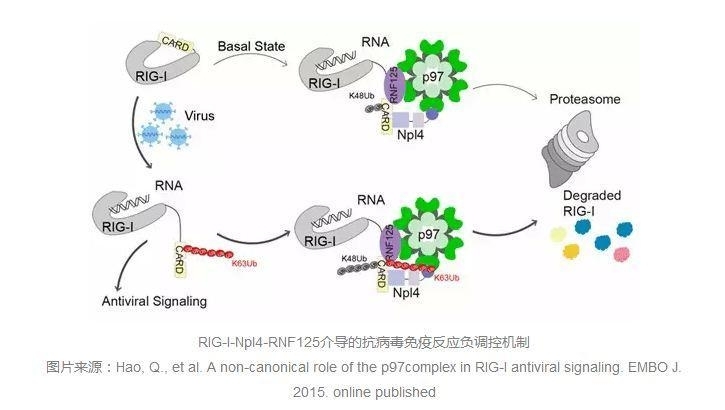
此项研究的意义具有两点意义:
首先,病毒等微生物进入机体后打开RIG-I信号介导的细胞先天免疫应答,当危险被清除后,该信号通路需要及时下调或关闭。本文的意义是为大家揭示了一种新的免疫应答负调控模式——p97-Epl4复合物介导RIG-I降解。其次,在早期研究中,科学家已经证实p97本身就是重要的癌症药物作用靶点,并研发了特异性的抑制剂来选择性地激活细胞程序性死亡。本文在此基础上提出了新的观点,认为今后针对p97抑制剂开发对癌症的直接治疗和术后的抗病毒防御都有非凡的意义,而p97-Npl4复合体负调控新机制的发现对寻找并合成相应的抑制剂大有裨益。
我要评论




共0条评论