我的博文
肾源性腺瘤临床病理形态学特征文献分析
1前言
肾源性腺瘤(nephrogenicadenoma,NA)也称肾源性化生( nephrogenic metaplasia),是一种少见的泌尿道良性肿瘤样病变,可累及泌尿道任何部位,主要发生于膀胱(约80%),主要在膀胱三角区和后顶壁,而尿道、输尿管及肾盂等也可发生,亦有报道发生于泌尿道憩室内及前列腺等部位。由于其发病机制尚不甚明确,易被误诊为其他良恶性肿瘤,1949年由Davis首次发现并根据其组织学特征取名为膀胱错构瘤,1950年Friedman和Kuhlenbeck等人发现该肿瘤形态与中肾管相似,认为其起源于残留中肾管,将其命名为NA。文献报道亦曾用过不成熟尿路上皮化生、腺瘤样化生、腺瘤样瘤、肾源性化生等名称,极少累及整个泌尿生殖系统。该肿瘤目前国内外文献报道不多,笔者现复习相关文献资料,分析其临床特征、病理形态学特征及免疫表型、发病机制、临床治疗及预后,望能提高该肿瘤的初步认识。
2 发病机制
目前对该肿瘤发病原因尚未明确,主要有三种学说。①先天发育异常:早期观点认为NA是一种发育异常,可能源于胎儿时发育异常的中肾管残存。②化生性病变:由于长期炎症或其他慢性刺激因素所造成的尿路上皮细胞增殖性化生性病变,包括长期泌尿道感染、泌尿生殖系统手术史、机械性损伤、膀胱灌注治疗(卡介苗或吉西他滨等)及肾移植免疫抑制剂应用等。③肾小管细胞种植。Bhagavan等在1991年电子显微镜发现NA具有肾近曲小管超微结构,且无Tamm-Horsfall蛋白(尿路上皮特有黏蛋白),推测NA可能来源于脱落的肾小管细胞。Mazal等于2002年采用X和Y染色体FISH分析肾移植患者NA病例,结果示NA染色体型与供肾者染色体型一致,而非受肾者染色体型;抗肾小管抗原免疫组化分析亦均支持NA中上皮细胞来自肾小管上皮细胞,而非来自尿路上皮细胞,但不能解释为何肾小管上皮可在膀胱间质中生长及在非移植患者膀胱中能否也能发生肾小管上皮种植。同时Tong等运用免疫组织化学方法对39例非肾移植患者NA研究发现强表达肾脏特异性转录因子PAX2,提示非肾移植患者NA来源于脱落自体肾小管上皮细胞。最近Sceizi等报道长期滥用非甾体抗炎药可导致膀胱NA发生,但两者是否存在特异性联系还需要大量病例证实,因此建议将滥用解热镇痛药作为该病发生独立因素,因此对于NA发病机制需要更进一步研究考证。
3 临床特征
患者年龄4-81岁,平均年龄38±5岁,男性较多见,男女比约为2:1;儿童发病不足10%,且多为女性。膀胱NA通常缺乏特异性临床表现,多数患者因体检或诊治其他系统疾病时发现膀胱占位而就诊,少部分患者因出现较严重临床症状来就诊,如全程无痛性肉眼血尿、尿频、尿急、尿痛等刺激症状、会阴部疼痛及药物难以缓解的膀胱刺激症状等。发生于尿道前列腺部则常出现尿路梗阻及夜尿症;发生于输尿管及肾盂则主要为腰部疼痛及镜下血尿,腰痛多是由肿物或结石引起的输尿管梗阻扩张和肾积水所致。由于输尿管及肾盂部位NA的肿物组织填塞容易形成上尿路梗阻,其可能严重影响单侧肾功能,甚至发生肾衰竭。
超声检查多提示患侧肾积水,梗阻上段输尿管扩张。CT及静脉肾盂造影(IVU)有助于显示输尿管NA病变部位及造成梗阻程度,逆行尿路造影检查可能发现结石周围或结石下方输尿管腔内有充盈缺损,有助于诊断。 B超可见膀胱区不随体位改变高回声影,KUB可出现骨盆区钙化灶,影像学上主要表现为膀胱壁局限性或弥漫性占位,很难与其他膀胱肿瘤或炎性病变区别,此时膀胱镜活检不失为一种重要的确诊手段,因此若术前怀疑为膀胱占位拟行根治性膀胱切除术时一定先获取活检,避免误诊误治发生。
4 病理形态学特征
NA肉眼观多呈息肉状、乳头状或扁平状,以单发为主,20%病例为多发,体积多较小,直径一般<1cm,亦有位于膀胱病变大至7cm者,有些病变形态学非常类似于低级别乳头状尿路上皮癌。镜下表现主要有3种组织形态学类型:小管型、囊状和乳头状,此外实体型或纤维黏液型少见,最近有文献报道可呈扁平状结构。镜检示混合型为主,以管状最为常见(约40%),类似于肾小管或中肾样小管,小管可小而圆,也可呈囊状,管周围绕明显基底膜,管腔内含嗜酸或嗜碱性分泌物。被覆单层立方或低柱状上皮细胞,部分呈“鞋钉”样上皮,细胞质呈嗜酸性或透明呈空泡样,胞核圆形或椭圆形,胞核略增大但异型性不明显,未见核分裂象,间质有明显淋巴浆细胞浸润。肿瘤一般位于固有层内,不侵犯肌层,但也有少数病例报道可侵犯至周围脂肪组织。
NA免疫表型CK7、EMA、HCK、水通道蛋白-1等多呈阳性,部分肿瘤P504S(AMACR)阳性,而P63、CD31、PSA、CD10、PSA、PAP等为阴性,Ki67增殖指数一般<5%,可作为和其他恶性肿瘤鉴别依据之一。近年来有文献报道PAX2和PAX8在NA中特异性表达,故可与其他抗体联用为NA诊断及鉴别诊断提供依据,此外Cossu-Rocca等报道S-100A1在NA中阳性率达94%。电镜下超微结构无特异性,腺管外有增厚的基底膜包绕,管腔面有微绒毛形成刷状缘,细胞内可见髓鞘样结构、大量增大的线粒体和聚集的糖原。
膀胱NA虽为良性病变,2000年Cheng等提出不典型肾源性腺瘤(atypical nephrogenic adenoma,ANA),与NA区别在于胞核增大,核深染,染色质增粗,核仁明显增大,但其复发率高达28%-90%,但仍认为其仍属良性病变。有相关文献报道长期使用免疫抑制剂会造成恶变,最终发展为膀胱腺癌、鳞癌及透明细胞癌等,此外少数免疫功能正常患者也可恶变。2006年报道1例膀胱NA转为透明细胞腺癌,2008年报道1例膀胱NA转为膀胱腺癌。国内孔繁辉等研究阐述2例膀胱NA恶变者侵犯浅肌层,且发生骨转移,所以其是否为癌前病变,恶变风险如何及发生转移具体机制等有待进一步研究。
5 鉴别诊断
①腺囊性膀胱炎(cystitis glandularis/cystitis cystica):腺囊性膀胱炎为膀胱固有膜增生形成巢状细胞岛,故需与膀胱NA鉴别。但该肿瘤细胞岛多为尿路上皮且常常为复层排列,并可伴有肠化生,35%病例可表达PSA;而NA由中肾小管样或肾小管样腺管构成,腺腔内有独特嗜酸性粉染物质,不表达PSA。少数情况下两种病变可以混合存在,但不影响临床治疗方式选择。
②前列腺腺癌(prostatic adenocarcinoma):当NA发生于前列腺时易被误诊为前列腺腺癌,因此NA也被认为是一种显著前列腺癌形态学模拟物,尤其当NA位于尿道前列腺部时。两者在镜下均表现为管状结构,小腺体增生,可分泌黏液,前者腺体排列更杂乱,常浸润间质,肿瘤细胞异型性更大,常见显著大核仁。但仅依靠病理形态学特征有时难于区分,可用免疫组化染色相鉴别。虽然前列腺癌和NA在P504S标记物上均为阳性,但是NA免疫标记物PSA阴性,若能检测到PAX2和PAX8阳性,结合形态学特征则更易与前列腺癌相鉴别。近年来文献研究发现前列腺特异性雄激素调控同源盒基因标记物NKX3.1可能是鉴别NA及前列腺癌的有效免疫标志物。
③膀胱透明细胞癌(clear cell carcinoma,CCA):在WHO(2016)泌尿系统肿瘤分类中将其归入苗勒型肿瘤,见于中老年女性,肿瘤体积较大。其鉴别诊断要点如下:①组织学结构:CCA可有实性结构,其乳头状结构多分支复杂,管状结构则相对较大且大小不一,肿瘤细胞排列呈单层或多层,而NA以管状结构最常见,且多数体积小,管腔小或不明显,大小相对一致,乳头状结构则仅见于黏膜表面且乳头分支少,细胞排列呈单层,实性罕见;②细胞学形态:CCA肿瘤细胞体积较大且胞质丰富,且透明细胞更多见,可见细胞异型性,明显核仁和核分裂象,而NA胞质少,嗜酸性细胞多见,偶有异型性,核仁和核分裂象少见;③坏死和浸润,NA局限于黏膜内,无肌层浸润,癌性间质反应和坏死,而CCA可出现坏死、肌层浸润和癌性间质反应。④CCA和NA免疫组化标记多有重叠,在两者鉴别诊断意义不大。免疫表型差异主要是NA多数Ki-67增殖指数低于10%且P53阴性;而CCA中Ki-67增殖指数高,平均为50%,且多数表达P53。
④膀胱尿路上皮癌(urothelial carcinoma,UC):当NA呈管状、囊状或实性结构,且病变边界不规则,并浸润固有层或浅肌层时,容易混淆为巢状和微囊变异型UC。UC肿瘤细胞呈巢团状生长,上皮细胞层数增加且细胞极向消失,可深达肌层甚至侵犯膀胱壁全层,胞核明显异型性,核分裂象较易见。巢状和微囊变异型UC通常不会有乳头状、小管状、囊状或扁平状等结构同时出现,而这一特征是NA特征性表现。间质纤维化是UC特征,而疏松间质和慢性膀胱炎背景则倾向于NA。此外UC肿瘤细胞常弥漫表达P63等,Ki-67增殖指数较高,但一般不表达PAX2及PAX8。
6 临床治疗及预后
膀胱NA有多种治疗手段,包括经尿道膀胱肿物切除术、腹腔镜膀胱部分切除术或根治性切除术+尿流改道及膀胱灌注治疗等。由于经尿道膀胱肿物电切或铥激光剜除术创伤小且疗效明显,目前已成为首选治疗方式,另外该肿瘤与泌尿系统感染、结石、创伤等因素有关,同时处理原发病也非常重要。虽然肿瘤不侵犯浅肌层,但建议电切尽可能达深肌层,范围包括病灶周围2cm组织,这样可极大程度减少残留及避免短期复发。若病灶离输尿管开口较近,术前放置输尿管支架可避免术中损伤输尿管及术后输尿管狭窄闭锁,术后辅以药物碱化尿液可促进上皮细胞生长以及预防创面钙盐沉积。当病灶弥散多发、症状严重的患者可考虑膀胱部分切除术或根治性膀胱切除术+尿流改道。此外透明质酸钠膀胱灌注不失为一种治疗手段,有文献报道膀胱灌注透明质酸钠可治愈NA,其具体原因可能是由于膀胱间质细胞较疏松,而透明质酸钠主要成分为黏多糖,对保护及修整不规则细胞氨基酸黏多糖层有重要作用,此外透明质酸钠可缓解膀胱刺激症状及提高膀胱顺应性。
鉴于有少数NA复发甚至恶变报道,极少数伴长期泌尿系统感染和长期使用免疫抑制剂NA患者可发生恶变,故术后前2年随访监测尤为重要。因此即便完全切除肿瘤,患者术后也应严密随访观察,随诊项目包括:盆腔MRI,全腹部平扫+增强CT,每3月复查膀胱镜,必要时可完善骨扫描。此外笔者认为存在复杂及多发者和某些具有细胞学非典型性NA病例有必要长期随访监测。
7小结
NA属尿路上皮的一种良性化生性病变,总体上临床预后良好,但具有复发倾向,极少数可恶变;在有反复经尿道手术史、既往有尿路上皮癌史或膀胱灌注史患者中尤其多见。目前多认为其发病机制与肾小管细胞异位自体移植相关,术前影像学表现无特异性,临床症状以尿路刺激征多见,手术首选经尿道电切或激光切除,依靠病理组织学及免疫组织化学可明确诊断,术后仍需继续随访监测。
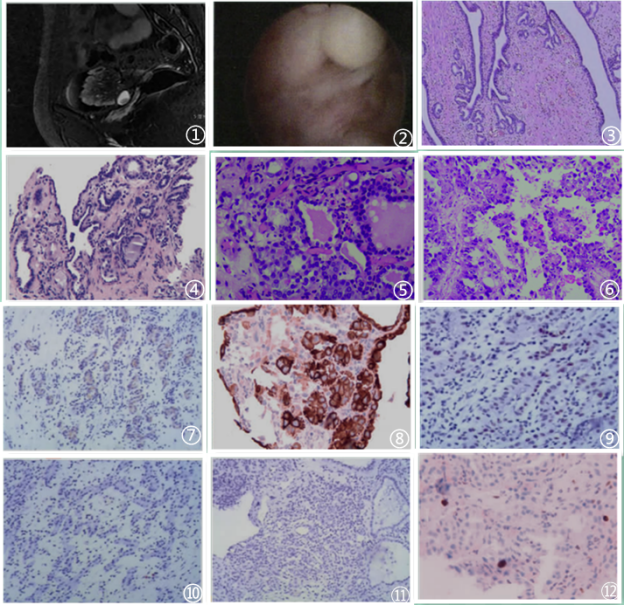
图1影像学示膀胱占位;图2肿瘤大体息呈肉样隆起;图3低倍见表面部分被覆尿路上皮,其内部分见子宫内膜样腺上皮;图4肿物表面呈乳头样,被覆立方或矮柱状上皮细胞;图5腺样和小囊状结构混合存在,内含嗜酸性分泌物;图6膀胱CCA以乳头状结构为主,乳头复杂,细胞排列呈复层,肿瘤细胞大,立方状或卵圆形,见鞋钉样细胞,胞核深染,形状不规则呈多形性,核仁明显,核分裂易见;图7肿瘤细胞AMACR阳性表达,EnVision 法;图8肿瘤细胞CK7弥漫强阳性,EnVision 法;图9肿瘤细胞PAX8核阳性,EnVision 法;图10肿瘤细胞PSA阴性,EnVision 法;图11肿瘤细胞P63阴性,EnVision 法;图12肿瘤细胞增殖指数低表达,Ki67约2%,EnVision 法;图片来自于参考文献,如有侵权,请联系删除。
我要评论





共0条评论