我的博文
Cell:改造T细胞来靶向肿瘤细胞,精细调控基因开关
来源:药明康德
最近,细胞疗法的专家、加州大学旧金山分校(UCSF)教授霍华德,休斯医学研究所的研究员,兼初创公司Cell Design Labs的科研创始人Wendell Lim博士推出了一项有关T细胞免疫疗法的崭新技术。这一成果发表于近期的《Cell》期刊上,报导了一种使用synNotch受体技术,精细调控基因开启或关闭,特异性启动T细胞免疫反应来靶向肿瘤细胞。
通过长期进化过程,人类的免疫细胞可有效监控和感知身体异常。致病菌入侵或者机体内的动态平衡都可激发免疫响应,启动一系列的保护和修复程序。诸如说,T免疫细胞在身体内循环、探知病源,并启动有力的响应效益来消除感染、炎症或癌症细胞。 T细胞也具备产生长期记忆的能力,可长久防止复发产生。这些应对疾病的强大能力,使得T细胞成为细胞疗法领域极具吸引力的一大技术平台。
目前,在工程化T细胞疗法领域,治疗癌症的重大进展都集中在“指导”T细胞的自然应答去针对疾病细胞。以此为方向,科学家们使用肿瘤特异性T细胞受体(TCR)或嵌合抗原受体(CARs)技术把T细胞改造成为可识别疾病新抗原的“新型”免疫功能细胞。虽然这些“重新定向”指导T细胞功能的疗法已经在部分癌症中取得了一些成功,其有效性仍受到了T细胞内源反应机制性质的大幅限制:首先,T细胞的免疫反应程序是多样化的,而且并不是所有方面都在特定疾病治疗方案上面具有益处。特别是某些免疫反应本身是有毒副作用的,在某些情况下可能和疾病本身一样危险。此外,自然的T细胞反应程序缺乏适应特性。例如,当工程化T细胞被重新定向到识别肿瘤细胞之时,T细胞具有非常有限的能力去克服肿瘤的免疫抑制微环境。
▲synNotch受体技术(图片来源:Cell)
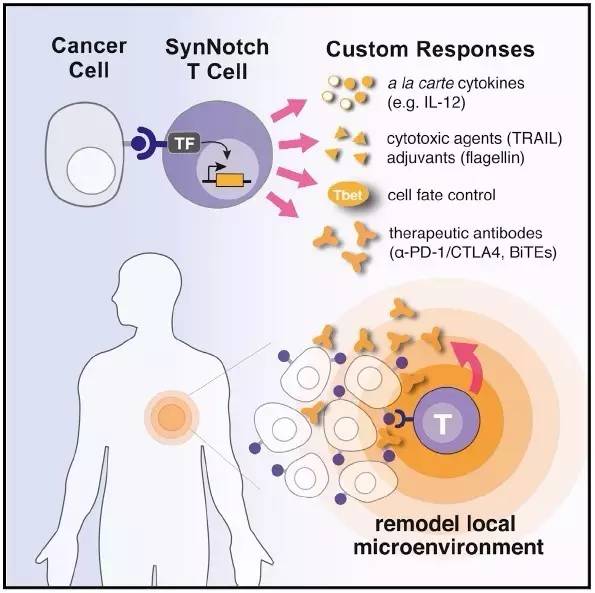
对于T细胞疗法的未来,最好能够塑造出由“指定的疾病环境”诱导激发出的新型抗肿瘤行为,驱动特定的免疫反应程序:即可最小化毒性,也可扩展治疗功效。最近开发出的synNotch受体技术提供了一种兼顾灵活定制和诱导免疫细胞反应的潜在方法。 SynNotch受体包含了天然的细胞间信号传导受体Notch的核心调节结构域,但具有合成性的胞外识别结构域和合成性的胞内转录结构域。当接合同源抗原时,类似于原生型的Notch活化机制,synNotch受体可经历诱导性跨膜区域剪切,从而释放胞内转录区域进入细胞核,结合同源上游顺式激活子来激活受调控靶向基因的表达。因此,synNotch信号回路可被利用产生“合成性”的细胞反应程序:使用特定的抗原识别结合来驱动某一特定的基因表达组合。
正是借鉴已建立的SynNotch受体技术,Wendell Lim博士的研究团队在人源原代T细胞中建立了能够检测相关肿瘤疾病的synNotch受体,以及关联特定基因调控的活性。这些经synNotch受体技术改造的T细胞具备强大且高度受控的“自定义”行为。研究数据表明,synNotch受体可以驱动的T细胞以产生自定义的细胞因子谱系,限定性的细胞分化途径,和局部递送的天然兼合成的治疗效益(例如细胞毒性蛋白质、抗体、双特异性扣合、免疫刺激剂和免疫抑制剂)。这些特定性的细胞行为绕过所有典型性T细胞活化的要求。
Lim博士说道:“我认为这是一个非常重要的技术。增强T细胞功能,超越现今CAR-T疗法相对有限的应用已经进入后期发展阶段了。”他很看好该技术从小鼠往人体实验的发展,重编程的工程化细胞可以成为治疗癌症以及自身免疫性疾病的创新方法。
目前Cell Design Labs公司已经募集了3440万美元,计划一两年内步入临床研究,尝试探索来自自体细胞的人体化治疗。
我要评论






共0条评论