我的博文
胰腺癌综合诊治中国专家共识
来源:临床肿瘤学杂志
1、前言
据世界卫生组织统计,2008年全球胰腺癌发病率和死亡率分别列恶性肿瘤第13位、第7位[1]。2013年最新统计数据显示,在发达国家(美国)胰腺癌新发估计病例数列男性第10位,女性第9位,占恶性肿瘤死亡率的第4位[2]。据《2012中国肿瘤登记年报》统计,2009年胰腺癌占我国恶性肿瘤发病率和死亡率的第7位和第6位。在我国上海等经济发达地区,胰腺癌新发估计病例数列男性第6位,女性第7位,并且呈快速上升趋势。一般认为吸烟、高脂饮食和体重指数超标可能是胰腺癌的主要危险因素。另外,糖尿病、过量饮酒以及慢性胰腺炎等与胰腺癌的发生也有一定关系。
国内、外的研究表明,大约60%的胰腺癌患者在确定诊断时已发生远处转移,25%患者为局部晚期,不能行根治性切除术,中位生存期仅为6~9个月[3-4];能够手术切除的仅15%,中位生存期15个月,5年生存率5%左右。
由于我国幅员辽阔,各地医药卫生事业发展不平衡,各级医院的医疗水平参差不齐,为了进一步规范胰腺癌的诊断与治疗,提高多学科综合诊治水平,改善患者生活质量和延长生存时间,中国临床肿瘤学会(CSCO)胰腺癌专家委员会组织国内胰腺癌专业领域多学科专家制订《胰腺癌综合诊治中国专家共识》(以下简称为共识)。
本共识仅适用于胰腺导管上皮来源的恶性肿瘤(胰腺癌)。
①注1:推荐等级原则
GradeA:具有较强的证据,即有1个Ⅲ期随机对照试验证据,或2个或以上Ⅱ期随机对照试验且结果较为一致,全部专家达成共识推荐;
GradeB:具有证据,即有1个或以上Ⅱ期或Ⅲ期随机对照试验,超过半数专家达成共识推荐;
GradeC:尚无证据,超过半数的专家达成共识推荐;GradeD:尚无证据,少于半数的专家达成共识推荐。
②注2:本共识不能涵盖所有可能的临床情况,鉴于各期胰腺癌预后都较差,建议各阶段的患者均可考虑参加临床研究。
2、多学科综合诊治原则及流程
2.1 多学科综合诊治原则
在胰腺癌的诊治过程中,强调遵循多学科综合诊治的原则,肿瘤内科、肿瘤外科、放疗科、影像科和病理科等学科专家共同参与,根据肿瘤的分子生物学特征、病理类型和临床分期等,结合患者的体能状况等进行全面的评估,制定科学、合理的诊疗计划,积极应用手术、放疗、化疗、介入以及分子靶向药物等手段综合治疗,以期达到治愈或控制肿瘤发展、改善患者生活质量、延长生存时间的目的。
注:胰腺癌患者的体能状况评估有别于其他肿瘤,全面体能状态评估应该包括体能状态评分(performance status,PS)、疼痛、胆道梗阻和营养状况四个方面。
体能状态良好具体标准如下:
(1)PS评分≤2分;
(2)疼痛控制良好,疼痛数字分级法(NRS)评估值≤3;
(3)胆道通畅;
(4)体重稳定。
2.2 多学科综合诊治流程参见图1。
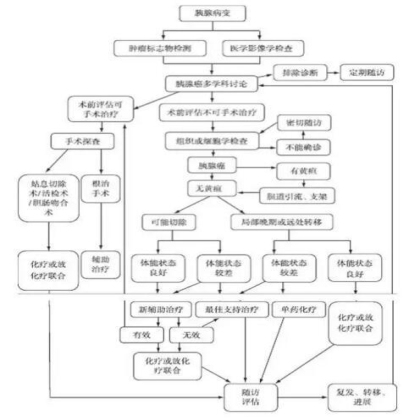
3、胰腺癌的诊断与鉴别诊断
3.1 临床表现
多数胰腺癌患者起病隐匿,早期症状不典型,可以表现为上腹部不适、隐痛、消化不良或腹泻,常易与其他消化系统疾病相混淆。
(1)疼痛:常表现为不同程度、不同方式的上腹部或腰背部疼痛,有时以夜间为甚,可以呈束带状分布。
(2)黄疸:不明原因的梗阻性黄疸,进行性加重,多见于胰头部肿瘤。
(3)体重下降:多数患者可以出现不明原因的消瘦、体重减轻,往往在短期内体重较快地下降。
(4)厌食、消化不良和腹泻等症状:近期出现不能解释的消化不良症状。
3.2 体格检查
早期一般无明显体征,当疾病处于进展期时,可以出现黄疸、肝脏增大、胆囊肿大、上腹部肿块以及腹腔积液等阳性体征。
3.3 实验室检查
(1)生化检查:早期无特异性血生化指标改变,肿瘤阻塞胆管时可引起血胆红素升高,伴有丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)及碱性磷酸酶(AKP)等酶学改变。
(2)血液肿瘤标志物检查:临床上常用的与胰腺癌诊断相关肿瘤标志物有糖类抗原CA19-9、癌胚抗原(CEA)、糖类抗原CA50和糖类抗原CA242等,其中CA19-9可以≥正常值的10倍。对于CA19-9升高者,应排除胆道梗阻和胆系感染才具有诊断意义。
3.4 影像学检查
协助诊断胰腺癌的医学影像学技术和手段较多,包括B超、CT、MRI、ERCP、PET-CT和EUS等,其特点各不相同。根据病情,选择恰当的影像学技术是诊断胰腺占位的前提。由于各种检查技术的特点不同,选择时应遵循“完整(显示整个胰腺)、精细(层厚2~3mm的薄层扫描)、动态(动态增强、定期随访)、立体(多轴面重建,全面了解毗邻关系)”的基本原则。
(1)B超检查:简单、方便、实时和无创,可用于胰腺癌的初步诊断和随访,对肝脏、胆管和较大的胰腺肿块具有较高诊断价值。超声造影技术可用于胰腺癌的早期诊断。
(2)CT/CTA:是诊断胰腺疾病的常用影像技术。不同CT扫描技术的侧重点各异:①上腹部平扫及增强扫描可显示较大的胰腺肿瘤和肝脏、胰腺旁淋巴结;②中腹部薄层动态增强/胰腺薄层动态增强(扫描层厚度≤3mm)是诊断胰腺病变的最佳CT技术;③多平面重建(MPR)是显示胰腺肿块毗邻关系的最佳技术;④CT血管造影(CTA)是显示胰腺相关血管病变的理想技术。
(3)MRI/MRCP/MRA:是诊断胰腺疾病的常用影像技术。①常规上腹部平扫及增强扫描:主要用于显示较大的胰腺肿瘤和肝脏、胰腺旁淋巴结;②中腹部薄层动态增强/胰腺薄层动态增强:是显示胰腺肿瘤的最佳MRI技术,在显示合并的水肿性胰腺炎方面优于CT;③MRCP:与中腹部MRI薄层动态增强联合应用,诊断价值更高。
(4)ERCP:可以发现胰管狭窄、梗阻或充盈缺损等异常。
(5)PET-CT:主要价值在于辨别“胰腺占位”的代谢活性,另外在发现胰腺外转移方面也具有明显优势。
(6)EUS:可以判断胰腺病变与周围组织结构的关系,引导对病变采取穿刺活检、引流等诊治操作。
3.5 组织病理学与细胞学检查
组织病理学和/或细胞学检查是确诊胰腺癌的唯一依据和金标准。因此,应尽可能在制订治疗方案前获得细胞学或组织病理学检查结果,但是考虑到临床实际情况,有时无法获得组织病理学或细胞学依据以明确诊断,可以结合病史、临床表现、实验室检查和影像学检查,由多学科专家讨论后慎重做出临床初步诊断,并且动态观察;而讨论后仍无法诊断时必须严密随访复查。
获得组织病理学或细胞学标本的方法:
(1)手术:直视下活检,是获取病理组织学诊断的可靠方法。
(2)脱落细胞学检查:可以通过胰管细胞刷检、胰液收集检查、腹腔积液化验等方法获得细胞病理资料。
(3)穿刺活检术:如无法手术患者,治疗前推荐在影像介导下,局部穿刺获得组织病理学或细胞学标本。
注:拟行手术切除的患者通常不需先获得病理学诊断支持,但在进行放、化疗等治疗前应明确病理学诊断。
4、胰腺癌的病理类型及分期
4.1 组织学类型
参照2010年第4版WHO消化系统肿瘤新分类[5]。
(1)起源于胰腺导管上皮的恶性肿瘤(适用于本共识的胰腺癌病理类型):
导管腺癌
腺鳞癌
胶样癌(粘液性非囊性癌)
肝样腺癌
髓样癌
印戒细胞癌
未分化癌
未分化癌伴破骨巨细胞样反应
(2)起源于非胰腺导管上皮的恶性肿瘤
腺泡细胞癌
腺泡细胞囊腺癌
导管内乳头状粘液性肿瘤伴浸润性癌
混合性腺泡-导管癌
混合性腺泡-神经内分泌癌
混合性腺泡-神经内分泌-导管癌
混合性导管-神经内分泌癌
粘液性囊性肿瘤伴浸润性癌
胰母细胞瘤
浆液性囊腺癌
实性-假乳头状肿瘤
4.2 分期
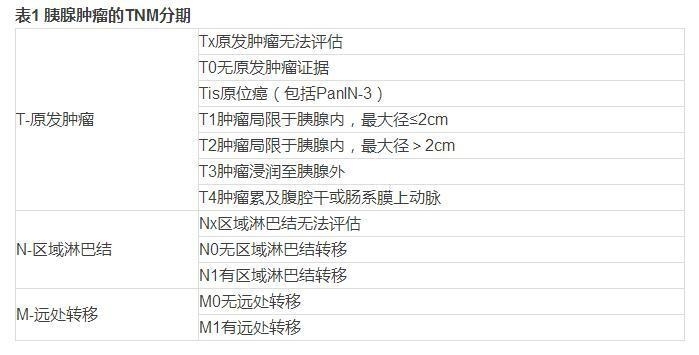
4.2.1 胰腺肿瘤TNM分期(AJCC第7版)参见表1。
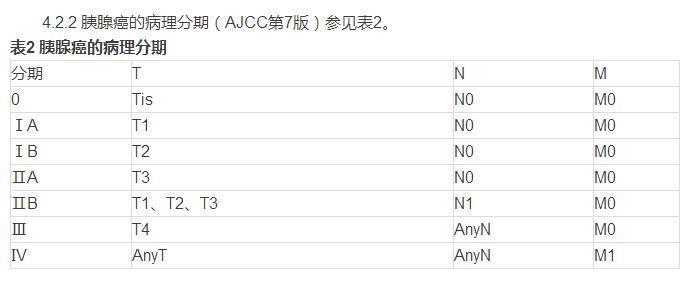
5、胰腺癌的治疗原则
5.1 外科治疗原则
手术目的是实施根治性切除(R0)。根据综合诊治的原则,术前应该进行多学科讨论,充分评估根治性切除的把握性,还要明确肿瘤是否有远处转移和合并症;对疑似有远处转移而高质量的CT/MRI检查仍然无法确诊的患者,应该进行PET-CT扫描检查。
5.1.1 可根治切除胰腺癌手术治疗
通过影像学检查,判断肿瘤可根治切除的标准是:无远处转移;无肠系膜上静脉-门静脉扭曲;腹腔干、肝动脉和肠系膜上动脉周围脂肪间隙清晰。
推荐:针对胰头癌,应进行标准的胰十二指肠切除术,需完整切除钩突系膜;肠系膜上动脉右侧、后方和前方的淋巴脂肪组织,根治性手术应达到胆管、胃(或十二指肠)、胰颈和后腹膜切缘阴性(GradeA)。扩大区域淋巴结清扫不能改善患者的预后(GradeA)。对胰体尾癌应行胰体尾和脾切除术;部分肿瘤较小的患者,可考虑腹腔镜胰体尾切除术(GradeC)。肿瘤累及全胰或胰腺内有多发病灶,可以考虑全胰切除术。
证据:
(1)Konstantinidis等[6]对544例胰十二指肠切除标本的切缘状态和患者的预后分析发现,R0切除患者的中位生存期是23个月,而R1切除患者是14个月(P<0.001)。
(2)Iqbal等[7]的荟萃分析发现,扩大淋巴结清扫术虽然增加清扫的淋巴结数量和降低切缘阳性的比例,但胃排空延迟的发生率增高,患者的生存期无明显延长。
(3)针对胰体尾癌的腹腔镜胰体尾切除在技术上是安全可行的,但是否可以达到与开腹手术一样的肿瘤根治效果,尚缺乏大样本的前瞻性对照研究,现有的小样本前瞻性研究和一些回顾性分析获得的结论存在矛盾和争议[8-9]。
5.1.2 可能切除(borderlineresectable)胰腺癌的手术治疗
可能切除的标准是:无远处转移;肠系膜上静脉-门静脉有狭窄、扭曲或闭塞,但切除后可安全重建;胃十二指肠动脉侵犯达肝动脉水平,但未累及腹腔干;肿瘤侵犯肠系膜上动脉未超过周径的180度。
推荐:部分可能切除的胰腺癌患者可从新辅助放化疗中获益(GradeB);联合静脉切除如能达到R0切除,则患者的预后与静脉未受累及的患者相当(GradeB);联合动脉切除不能改善患者的预后(GradeA)。鉴于目前缺乏足够的高级别的循证医学依据,对可能切除的胰腺癌患者推荐参加临床研究。
证据:
(1)Gillen等[10]的荟萃研究发现,可能切除的胰腺癌患者,术前经联合放化疗后可使部分患者获得根治性切除,5年生存率达到20%,与无血管侵犯的患者一致。
(2)Mollberg等[11]进行荟萃分析发现,在2243例患者中,366例患者接受了联合动脉切除的胰腺肿瘤切除手术,结果动脉切除组患者的并发症发生率显着升高,而预后较差。建议动脉切除应仅限于严格选择的患者。
5.1.3 姑息性手术治疗
经影像学检查,发现以下情况之一应判定为肿瘤不可切除:①远处转移;②不可重建的肠系膜上-门静脉侵犯;③胰头癌:肿瘤包绕肠系膜上动脉超过180度或累及腹腔干和下腔静脉;④胰体尾癌:肿瘤累及肠系膜上动脉或包绕腹腔动脉干超过180度。
推荐:手术探查时如发现胰头肿瘤无法切除,应予活检取得病理学诊断证据;对暂未出现十二指肠梗阻但预期生存期≥3个月的患者,建议做预防性胃空肠吻合术(GradeA);肿瘤无法切除但有胆道梗阻的患者,建议进行胆总管/肝总管空肠吻合术(GradeB);有十二指肠梗阻的患者,如预期生存期≥3个月,应行胃空肠吻合术(GradeB)。
证据:
(1)Jeurnink等[12]进行系统回顾发现,十二指肠支架置入对预期生存短的患者创伤小;胃空肠吻合术对预期生存较长的患者可维持吻合口通畅更长的时间。因纳入系统回顾的前瞻性研究较少,需要更大样本的前瞻性研究来证实该结论的可靠性。
(2)Gurusamy等[13]的研究发现,预防性胃空肠吻合组的患者出现远期流出道梗阻的比例是2.5%;而未行预防性胃空肠吻合组的患者出现远期流出道梗阻的比例是27.8%。因此对胰头肿瘤无法切除的患者,建议预防性胃空肠吻合。
5.2 内科治疗原则
根据综合诊治的原则,应进行多学科讨论评估,包括患者全面体能状况评估、肿瘤分期及分子标记物检查等结果,制定合理的内科治疗计划。
5.2.1 术后辅助治疗
与单纯手术相比,术后辅助化疗具有明确的疗效,可以防止或延缓肿瘤复发,提高术后长期生存率,因此,积极推荐术后实施辅助化疗[14]。术后辅助化疗方案推荐氟尿嘧啶类药物(包括替吉奥胶囊以及5-FU/LV)或吉西他滨(GEM)单药治疗;对于体能状态良好的患者,可以考虑联合化疗。
推荐:
(1)替吉奥胶囊(S-1)单药,每周期第1日至第28日,口服80~120mg/日,每6周重复,给药至6个月[15](GradeA)。
(2)吉西他滨单药,每周期第1、8、15日,静脉输注1000mg/m2,每4周重复,给药至6个月[16-17](GradeA)。
(3)5-FU/LV,每周期第1日至第5日,每日静脉输注亚叶酸钙20mg/m2,5-FU425mg/m2,每4周重复,给药至6个月[14](GradeA)。
(4)部分体力状态较好的患者,可采用含吉西他滨和/或替吉奥胶囊的联合化疗方案(GradeC)。
(5)参加临床研究。
证据:
(1)JASPAC-01(Ⅲ期临床试验)[15]:385例胰腺癌接受R0或R1切除术后患者,随机分为S-1或GEM辅助化疗组。结果显示,与GEM组比较,S-1组的死亡风险降低(HR=0.56),S-1组与GEM组的2年生存率分别为70%和53%;两组的无复发生存期分别为23.2个月和11.2个月。
(2)CONKO-001(Ⅲ期临床试验)[16]:354例胰腺癌切除术后患者,随机分为GEM组或单纯手术组。结果显示,GEM辅助化疗改善了DFS(两组DFS分别为13.4个月和6.9个月,P<0.001),长期随访结果显示GEM组患者的总生存期有显着优势(两组总体mOS分别为22.3个月和20.2个月,5年生存率分别为21%和9%,P<0.01)。
(3)ESPAC-1(Ⅲ期临床试验)[14]:289例胰腺癌切除术后患者,随机分为化疗组(5-FU/LV)、5-FU合并放疗组、化放疗+化疗组、单纯手术组,比较了含化放疗(2组)与不含化放疗(2组)、含化疗(2组)与不含化疗(2组)。结果显示,含化放疗组的总生存期劣于不含化放疗组(P=0.05),含化疗组与不含化疗组的mOS分别为20.1个月和15.5个月,即基于5-FU的辅助化疗能够显着改善总生存(P=0.009)。
(4)ESPAC-3(Ⅲ期临床试验)[17]:1088例胰腺癌切除术后患者,随机分为5-FU/LV和GEM组。结果显示,GEM组与5-FU/LV组的mOS没有统计学差异,分别为23.6个月和23个月,但GEM组的严重不良事件发生率显着降低。
5.2.2 新辅助治疗
对于可能切除的胰腺癌患者,如体能状况良好,可以采用联合化疗方案或单药进行术前治疗,降期后再行手术切除。通过新辅助治疗不能手术切除者,即采用晚期胰腺癌的一线化疗方案。
推荐:体能状况较好(ECOG评分0~1分)的患者,可采用联合化疗方案(GradeC)。5.2.3不可切除的局部晚期或转移性胰腺癌的治疗对于不可切除的局部晚期或转移性胰腺癌,积极的化学治疗有利于减轻症状、延长生存期和提高生活质量。
对体能状况良好者,一线治疗推荐治疗方案:
(1)化疗方案:
①吉西他滨+白蛋白结合型紫杉醇[18]:每周期d1、d8和d15给予白蛋白结合型紫杉醇125mg/m2,GEM1000mg/m2,每4周重复1次(GradeA)。
②FOLFIRINOX方案[19]:每周期d1,静脉注射奥沙利铂85mg/m2,伊立替康180mg/m2,亚叶酸钙400mg/m2,5-FU400mg/m2,之后46小时持续静脉输注5-FU2400mg/m2,每2周重复(GradeA)。
③吉西他滨单药[20]:GEM1000mg/m2,每周1次,连续给药7周,休息1周,之后连续3周,休息1周,每4周重复(GradeA)。
④吉西他滨+替吉奥胶囊[21-22]:每周期d1和d8,静脉注射GEM1000mg/m2;d1~d14,口服S-160~100mg/d,bid,每3周重复(GradeA)。
⑤替吉奥胶囊单药[21]:每周期d1~d28,口服S-180~120mg/d,bid,每6周重复(GradeA)。
⑥其他方案:吉西他滨+卡培他滨[23](GradeB);吉西他滨+顺铂(特别是对于可能为遗传性肿瘤的患者)[24](GradeB);固定剂量率吉西他滨、多西他赛、卡培他滨(GTX方案)[25];氟尿嘧啶+奥沙利铂(例如:5-FU/LV/奥沙利铂或CapeOx)[26]。
(2)化疗联合分子靶向治疗:
①吉西他滨+厄洛替尼[27]:d1、d8、d15、d22、d29、d36和d43静脉给予GEM1000mg/m2,休息1周,为第1周期;第2周期开始,d1、d8和d15给药,每4周重复。厄洛替尼每日口服100mg/d(GradeA)。
②尼妥珠单抗+GEM[28]:GEM1000mg/m2,静脉滴注30min,每周1次(d1、d8、d15,每3周重复)和尼妥珠单抗(固定剂量为400mg,每周1次,静脉滴注30min)。
(3)推荐参加临床研究。
对体能状况较差者,一线治疗推荐治疗方案:
(1)吉西他滨单药:给药方法同上。
(2)氟尿嘧啶类单药:替吉奥胶囊(GradeA)、卡培他滨(GradeB)或持续灌注5-FU(GradeB),给药方法同上。
对体能状况良好者,二线治疗推荐治疗方案:
(1)首选参加临床研究。
(2)既往未接受吉西他滨化疗的患者首选吉西他滨为基础的化疗。
(3)对于一线接受以吉西他滨为基础化疗的患者,二线治疗可选择以氟尿嘧啶类药物为基础的化疗方案,包括替吉奥胶囊单药[29-30]、卡培他滨单药、5-FU/LV/奥沙利铂、替吉奥胶囊/奥沙利铂[31]或卡培他滨/奥沙利铂;对于术后发生远处转移者,若距离辅助治疗结束时间>6个月,除选择原方案全身化疗外,也可选择替代性化疗方案。
对体能状况较差、不能耐受及不适合化疗者,二线治疗推荐治疗方案:
(1)欧美学者开展的随机对照研究表明,二线化疗比最佳支持治疗(BSC)更有效,因此推荐进行二线化疗(GradeB)。
(2)可选择吉西他滨或氟尿嘧啶类为基础的单药化疗。
(3)最佳支持治疗(BSC)。
证据:
(1)MPACT(Ⅲ期临床试验)[18]:861例转移性胰腺癌患者,随机接受白蛋白紫杉醇联合吉西他滨或吉西他滨单药治疗。结果显示,吉西他滨+白蛋白紫杉醇的mOS为8.5个月,GEM单药为6.7个月(HR=0.72,95%CI:0.617~0.835;P=0.000015),两组差异有统计学意义。在转移性胰腺癌初治患者中,GEM联合白蛋白紫杉醇的mOS较GEM单药明显延长,且耐受性良好。
(2)5-FU/亚叶酸钙+奥沙利铂+伊立替康联合方案(FOLFIRINOX)[19]:324例PS0~1转移性胰腺癌患者,随机采用FOLFIRINOX或GEM方案,比较评估其疗效。FOLFIRINOX的mOS为11.1个月,GEM组为6.8个月(P<0.001)。与GEM治疗相比,FOLFIRINOX方案的毒性反应发生率较高,是体力状况良好的转移性胰腺癌患者的治疗选择之一。
(3)吉西他滨+厄洛替尼[27]:569例晚期或转移性胰腺癌患者,随机分组接受厄洛替尼联合GEM或GEM单药治疗。结果显示,与GEM单药治疗组相比,厄洛替尼联合GEM组在mOS(HR=0.82,P=0.038)和mPFS(HR=0.77,P=0.004)方面均显示出有统计学意义的改善。厄洛替尼联合GEM组的mOS为6.24个月,1年生存率为23%,而GEM单药治疗组分别为5.91个月和17%。
(4)吉西他滨单药[20]:GEM对比5-FU治疗无法切除的晚期胰腺癌患者的Ⅲ期临床研究。结果显示,GEM组与5-FU组相比,mOS显着延长,分别为5.65个月和4.41个月(P=0.0025),症状缓解也有显着改善。
(5)替吉奥胶囊单药[21]:随机对照Ⅲ期临床研究GEST试验结果显示,S-1单药对比吉西他滨单药的总生存风险比为0.96(97.5%CI:0.78~1.18),S-1单药用于局部晚期或转移性胰腺癌患者的总生存期不劣于GEM单药治疗。
(6)GS方案[21]:Ⅲ期随机对照临床研究GEST试验结果显示,与GEM单药相比,GS方案在总生存期方面并无优势,GS组的mOS为10.1个月,GEM组为8.8个月,但GS组的毒性更低。
(7)尼妥珠单抗+吉西他滨[28]:Ⅱ期随机对照临床研究结果显示,与GEM单药相比,GEM联合尼妥珠单抗组的mOS延长,分别为8.7个月和6.0个月(P=0.21),mPFS分别为5.4个月和3.7个月(P=0.06)。对于≥62岁的患者(占入组患者的60%),GEM联合尼妥珠单抗较GEM单药治疗获益明显,mOS分别为8.8个月和5.2个月(P=0.034),mPFS分别为5.5个月和3.2个月(P=0.0096)。
5.3 放射治疗原则
同步放化疗是局部晚期胰腺癌的主要治疗手段之一。以吉西他滨或5-FU类药物为基础的同步放化疗可以提高局部晚期胰腺癌的中位生存期,缓解疼痛症状从而提高临床获益率,成为局部晚期胰腺癌的标准治疗手段。另外,对于胰腺癌术后T3或腹膜后淋巴结转移病例、局部残存或切缘不净者,术后同步放化疗可以弥补手术的不足。术前新辅助放化疗也是目前对临界切除病例的研究热点。关于治疗适应证选择以及合理的剂量模式与局控率的关系尚无明确共识,调强放疗(IMRT)技术、TOMO以及包括X刀和伽玛刀的立体定向放射治疗(SBRT)技术正越来越多地用于胰腺癌的治疗,局部控制率和生存率获得了改善和提高[32-35]。
三维适形照射(3DCRT)通过在每一个照射方向上与肿瘤的形状相一致,使高剂量曲线集中在肿瘤区,从而使肿瘤得到高剂量的照射,同时可以避免其周围正常组织和器官的不必要照射,IMRT比3DCRT的适形度更好,对正常组织和器官保护得更好。
(1)治疗前准备和CT模拟定位:确保肿瘤范围、淋巴引流区和感兴趣的正常组织器官(一般指全部肝脏、双侧肾脏、胃和部分小肠)包括在扫描的范围内,CT扫描层距为3~5mm。(2)靶区及处方剂量的定义:靶区勾画包括肿瘤区(GTV)、临床靶区(CTV)、计划靶区(PTV)和危及器官(OAR)。根据CT图像或根据术中放置的金属标志勾画GTV(包括原发肿瘤和转移的淋巴结),CTV则为GTV外放的区域以及高危淋巴引流范围,PTV为考虑体内脏器移动及摆位误差的CTV外放5~10mm范围。要勾画的危及器官包括肝脏、双侧肾脏、胃、小肠和扫描范围内的脊髓。靶区处方剂量根据不同肿瘤情况确定。危及器官的限量为:脊髓≤40Gy,50%肝脏体积接受的照射剂量≤30Gy,30%双侧肾脏体积接受的照射剂量≤20Gy。
5.3.1 辅助放疗
术后辅助放疗尚存争议[36-39],目前尚缺乏高级别的循证医学依据,建议积极参与临床试验。但是对于切缘阳性(R1手术)胰腺癌,采用辅助性放化疗可改善患者的总生存(GradeA)[37]。推荐采用CT模拟加三维放射治疗计划。
(1)治疗体积应基于手术前CT扫描结果或手术置入的银夹来确定。
(2)标准放疗体积应包括原发肿瘤床和区域高危淋巴结区,例如胰腺头部肿瘤患者术后需包括胰十二指肠淋巴结、肝门区淋巴结、腹腔动脉淋巴结和胰上淋巴结区。
(3)治疗方案为氟尿嘧啶类或吉西他滨类同步放化疗,后续5-FU或吉西他滨维持治疗[40];吉西他滨或持续静脉滴注1周期5-FU后同步放疗,后续吉西他滨或持续静脉滴注5-FU[41];吉西他滨或静脉滴注5-FU/叶酸2~6周期,后续氟尿嘧啶类+同步放疗[42]。
(4)CTV放疗剂量为45Gy,瘤床区和切缘加量到50.4~54Gy(1.8~2.0Gy/f)[43]。
证据:
(1)GITSG91-73Ⅲ期试验[44]:辅助放化疗与观察相比,明显改善生存(mOS:20个月vs.11个月,P=0.035)。
(2)ESPAC-1Ⅲ期试验[14]:辅助放化疗与辅助化疗的mOS分别为15.9个月和17.9个月。分层分析显示,两组总生存没有统计学差异。基于5-FU的辅助化疗比非化疗组能够显着改善总生存(P=0.009)。
(3)Stocken等[37]的荟萃分析:辅助放化疗和无放化疗组的mOS分别为15.8个月和15.2个月(P>0.05)。对于切缘阳性患者,辅助放化疗优于辅助化疗。
(4)EORTC40891试验[39]:胰头癌病例术后随机分为同期放化疗组与单纯手术组,两组的5年生存率分别为20%和10%(P=0.09)。
(5)RTOG9704研究[41]:对胰腺癌患者进行术前化疗+手术+术后同步放化疗+术后化疗,比较术前/术后化疗中5-FU与吉西他滨的疗效,两组的术后同步放化疗均为含5-FU的同步放化疗。初步结果表明,在442例可供分析的胰腺癌患者中,381例胰头癌接受吉西他滨化疗者的mOS、3年生存率分别为20.6个月和32%,接受5-FU者为16.9个月和21%,前者显着优于后者(P=0.033),但是对全部442例患者进行生存分析时,两组的生存率未显示明显差别(P=0.20)。
5.3.2 新辅助放疗
对于可切除及可能切除的局部晚期胰腺癌的新辅助治疗尚无标准方案,缺乏高级别的循证医学依据,建议参与临床试验。目前的研究证据表明,临界切除的局部晚期胰腺癌接受术前放化疗可以提高手术切除率,并可改善患者生存[45](GradeA)。治疗方案包括氟尿嘧啶类(5-FU持续输注或含卡培他滨方案)[46-47],或含吉西他滨方案放疗[48],或诱导化疗(2~4周期)有效后采用含5-FU或含吉西他滨方案的同步放化疗[49]。
MDACC推荐的放疗剂量为:45~50.4Gy,1.8~2.0Gy/f或30Gy,3Gy/f。新辅助放疗的范围是GTV。
证据:
(1)FFCD9704-SFROⅡ期试验[47]:41例局部潜在可切除的胰腺癌患者术前接受50Gy/25f放疗联合5-FU持续静脉输注。在根治性手术切除的26例患者中,21例(80.7%)达到R0切除,26例手术患者的2年局部复发率和生存率分别为4%和32%。
(2)Ⅱ期试验[48]:86例Ⅰ/Ⅱ期胰腺癌患者术前接受30Gy/10f放疗联合吉西他滨方案化疗,mOS为22.7个月,5年生存率27%。(3)Ⅱ期试验[49]:90例Ⅰ/Ⅱ期胰腺癌患者术前接受30Gy/10f放疗联合吉西他滨方案化疗,mOS为17.4个月。接受胰十二指肠手术和未手术切除患者的mOS分别为31个月和10.5个月(P<0.001)。
5.3.3 不可切除的局部晚期胰腺癌的放疗
对于全身状况良好的不能切除的局部晚期胰腺癌,采用同步放化疗[50-51]或诱导化疗有效后放疗[52-56]可缓解症状和改善患者生存期(GradeA)。对于梗阻性黄疸的病例,放疗前建议放置胆道支架引流胆汁。回顾性临床资料分析表明,采用现代放疗技术治疗局限性胰腺癌可获得长期生存[32-33,35]。近期的研究支持,对拒绝进行手术治疗或因医学原因不能耐受手术治疗的可手术切除局限期胰腺癌和因肿瘤侵及或包绕大血管而病灶体积≤3cm的局限性胰腺癌进行放疗(GradeA)。由于梗阻、压迫或疼痛的转移性胰腺癌患者可给予减症放疗[57-58]。
(1)推荐采用CT模拟定位加三维适形放疗或调强放疗技术,有条件的单位推荐采用(图像引导放射治疗)IGRT技术[37,59],SBRT(X刀或伽玛刀)也可选用[32,34,36]。
(2)治疗体积基于增强CT和MRI扫描结果或手术所置入的银夹(如果放置的话)来确定。
(3)治疗范围包括原发肿瘤和转移淋巴结,以及对高危区域淋巴结进行预防照射。但也有文献认为对于不可手术切除的局部晚期胰腺癌,放疗范围倾向于只照射GTV,不包括高危淋巴结引流区,PTV为GTV+1.5~2cm(前后左右方向)和2~3cm(头脚方向)[60]。
(4)化疗方案单药可采用吉西他滨或氟尿嘧啶类药物(5-FU持续静脉滴注,或卡培他滨,或替吉奥),多药联合可采用吉西他滨或氟尿嘧啶类为基础的方案[50-53,61]。
(5)同步放化疗中放疗剂量为CTV45Gy[62-63]。美国与法国共同推荐针对局部晚期胰腺癌放疗总量为50~54Gy,每次分割剂量为1.8~2.0Gy[60]。
(6)术中放疗(IORT)通常在剖腹探查术中发现肿瘤无法切除或术中肿瘤切缘较近或切缘阳性时采用[64-65]。剖腹探查时,术中无法彻底切除或无法手术切除者,有术中照射设备的单位建议术中电子线照射放疗15~20Gy,术后(1个月内)补充外照射(EBRT)30Gy/10f或40Gy/20f。
证据:
(1)Ⅱ期临床研究[50]:60例局部晚期胰腺癌患者接受S-1同步放疗的mPFS为9.7个月,mOS16.2个月,1年生存率72%。
(2)CALGB9805Ⅱ期试验[51]:39例接受吉西他滨同步放疗的局部晚期胰腺癌患者的mOS为8.2个月,CA199下降患者的mOS为13.5个月。
(3)Huguet等[52]系统回顾研究:放化疗在改善生存上优于支持治疗(GradeC)和单纯放疗(GradeB),但毒性更多(GradeB);放化疗改善生存并不优于化疗(GradeB),而且增加毒性反应(GradeA)。诱导化疗后放化疗能改善生存(GradeC)。
(4)Ⅱ期临床研究[53]:323例局部晚期胰腺癌接受吉西他滨或氟尿嘧啶类同步放化疗,mPFS和mOS分别为5个月和9个月。同步放化疗与诱导化疗后同步放化疗相比,mOS分别为8.5个月和11.9个月(P<0.01),mPFS分别为4.2个月和6.4个月(P<0.01)。诱导化疗后放化疗可使局部晚期胰腺癌患者的生存获益。
(5)Ⅱ期临床研究[64]:322例胰腺癌患者接受IORT±EBRT,其中R0手术48例,R1手术35例,另外109例患者仅进行活检或减症切除,2年肿瘤局部控制率和总生存率分别为71%和17%。
(6)LAP07Ⅲ期临床试验[66]:纳入442例病情控制的局部晚期胰腺癌患者,随机给予4个月吉西他滨或联合厄洛替尼治疗(R1阶段),并对疾病得到控制的269例患者随机给予2个月GEM化疗或化放疗(CRT,54Gy;R2阶段)。R1阶段接受厄洛替尼治疗者维持治疗至协议终止。结果显示,中位随访36个月,在R2阶段,化疗和CRT患者的mOS分别为16.5个月和15.3个月(P=0.83)。
(7)2012年美国放疗年会[32]报道(Ⅱ期临床试验):174例不适宜手术和不能手术切除的非转移性胰腺癌接受立体定向放疗,中位剂量约60Gy,Ⅰ、Ⅱ和Ⅲ期患者的mOS分别为19.4个月、13.1个月和7.6个月;Ⅰ期的1、3、5年生存率分别为79%、32%和21%,Ⅱ期1、3、5年生存率分别为55%、15%和15%,而Ⅲ期的1、2、3年生存率分别为33%、12%和3%。
(8)李光等[33]报道(Ⅱ期临床试验):81例Ⅱ期和Ⅲ期胰腺癌接受55~60Gy多野适形放疗,1、3、5年生存率分别为72%、20%和4%。(9)常冬姝等[35]报道(Ⅱ期临床试验):111例局限期胰腺癌接受立体定向放疗60~70Gy,总有效率72%,局限期(Ⅰ/Ⅱ期)1、3、5年生存率分别为68%、30%和17%;局部晚期(Ⅲ期)1、2、3年生存率分别为28%、14%和4%。
5.4 其他治疗建议
以下治疗方法尚缺乏充分的和高级别的循证医学证据,建议积极组织或参与多中心临床研究。
5.4.1 介入治疗
由于胰腺癌的供血多为乏血供和多支细小动脉供血等特征,介入治疗效果有限,推荐证据不足,可以采取超选择性供血动脉灌注化疗或栓塞做特殊治疗;对肝转移性病变可根据供血特征分别行供血动脉灌注化疗或化疗栓塞;但尚缺乏高级别的循证医学证据,需要进行大样本多中心临床研究以明确介入治疗的指征和意义。
适应证:
(1)梗阻性黄疸(胆管引流术或内支架置入术);
(2)不宜手术或者不愿意手术、接受其他方法治疗或术后复发的患者;
(3)控制疼痛、出血等疾病相关症状;
(4)灌注化疗作为特殊形式的新辅助化疗。
禁忌证:
(1)相对禁忌证:
①造影剂轻度过敏;
②KPS评分<70分或ECOG评分>2分;
③有出血和凝血功能障碍性疾病不能纠正及有出血倾向者;
④白细胞<4.0×109/L,血小板<80×109/L。
(2)绝对禁忌证:
①肝肾功能严重障碍:总胆红素>51μmol/L、ALT>120U/L;
②有明显出血倾向者:凝血酶原时间<40%或血小板<50×109/L;
③中等或大量腹腔积液、全身多处转移;
④全身情况衰竭者。
5.4.2 姑息治疗与营养支持
提高胰腺癌患者的生活质量是姑息治疗的重要目标。对于胰腺癌终末期患者应给予姑息治疗,其目的是减轻临床症状和提高患者生活质量。终末期肿瘤患者的症状可以大致归为两类,一类是疼痛,包括肿瘤引起的癌痛和器官累及引起的其他疼痛,如消化道中胆道梗阻引起的痉挛痛等;另一类是乏力相关症状,主要是由于营养摄入不足或代谢异常引起的营养不良。疼痛是胰腺癌最常见的症状之一,疼痛控制良好也是患者体能状况较好的标志之一。在明确疼痛的原因和排除外科急症后,要明确是否为癌痛。考虑癌痛者,根据WHO三阶梯镇痛的五大原则予以足量镇痛。
营养不良甚至恶液质在胰腺癌终末期患者中极为多见。应首先对患者进行恶液质的诊断与分期:恶液质前期,即体重下降≤5%并存在厌食或糖耐量下降等;恶液质期,即6个月内体重下降>5%,或基础BMI<20者体重下降>2%,或有肌肉减少症者体重下降>2%;难治期,即预计生存<3个月,PS评分低,对抗肿瘤治疗无反应的终末状态[67]。
在判定全身营养状况和患者胃肠道功能状况基础上制订营养治疗计划。生命体征平稳而自主进食障碍者,如患者有意愿时应予营养治疗,其中存在胃肠道功能者以肠内营养为主[68]。无胃肠道功能者可选择胃肠外营养,一旦肠道功能恢复,或肠内营养治疗能满足患者能量及营养素需要量,即停止胃肠外营养治疗。营养治疗同时应监测24h出入量、水肿或脱水、血电解质等。生命体征不稳和多脏器衰竭者原则上不考虑系统性的营养治疗。
糖皮质激素类药物和醋酸甲地孕酮能够增加食欲[69]。酌情选用能够逆转恶液质异常代谢的代谢调节剂,目前使用的药物包括鱼油不饱和脂肪酸(EPA)、二十二碳六烯酸(DHA)和沙利度胺等[70-73]。
5.4.3 中医药治疗
中医药是胰腺癌综合治疗的组成之一,与西医药相比,并非着眼于直接杀灭癌细胞,而是注重于“扶正”调理。中医药有助于增强机体的抗癌能力,降低放、化疗的毒性,改善临床症状,提高患者生活质量,并有可能延长生存期,可以作为胰腺癌治疗的重要辅助手段;但是目前中医药治疗胰腺癌的循证医学证据不多,尚缺乏高级别的证据加以支持,需要积极进行探索和大型随机对照的临床研究。
(1)中医药治疗胰腺癌的适应证:①早期胰腺癌根治术后的巩固治疗;②中晚期胰腺癌姑息性手术、放化疗后的巩固或维持治疗,或与放化疗的联合应用;③晚期胰腺癌无法手术或放化疗患者的治疗。
(2)辨证论治:目前尚无胰腺癌的辨证分型统一标准,最常见的证型有湿热毒盛型、气滞血瘀型、脾虚湿阻型和阴虚内热型,治疗上宜辨病与辨证相结合,实行个体化诊疗,以提高临床疗效。①湿热毒盛型:症见身目黄染,心烦易怒,口干口苦,食少腹胀,或胁肋疼痛,小便黄赤,大便干结,舌红苔黄腻,脉弦滑或滑数。治宜清热利湿,解毒退黄,茵陈蒿汤合黄连解毒汤加减。②气滞血瘀型:症见胁背疼痛,持续胀痛或刺痛,或窜及两胁,或有胁下结块,脘腹胀满,饮食减少,舌质紫暗或有瘀斑,苔薄白,脉弦涩。治宜行气活血,软坚散结,膈下逐瘀汤加减。③脾虚湿阻型:脘腹胀满或膨隆,食后加重,纳食减少,胁下或有隐痛不适,大便溏薄,舌苔白腻,脉细弦。治宜健脾益气,化湿行气,香砂六君子汤加减。④阴虚内热型:脘腹疼痛,五心烦热,或盗汗,口干咽燥,头昏目眩,大便干结,舌红少苔,脉细数。治宜滋养肝肾、清火散结,知柏地黄汤加减。
(3)现代中药制剂的应用:除辨证论治使用汤剂外,一些现代中药制剂如包括康莱特[74-75]、榄香烯乳、华蟾素及消癌平等,对于胰腺癌亦有一定控制肿瘤发展、减轻患者症状和改善生活质量的作用,可以酌情选择使用;但是这些药物治疗胰腺癌尚缺乏的高级别循证医学证据,需要临床上进一步观察和研究,积累资料。
6、胰腺癌的随访
对于临床上怀疑胰腺癌,尚难以与慢性胰腺炎、胰腺囊肿等疾病鉴别诊断时,应密切进行CT/MRI、PET-CT等影像学随访和CA19-9等血清肿瘤标记物检查;推荐随访的时间为每2~3个月1次。对于胰腺癌术后患者,术后第1年,每3个月随访1次;第2~3年,每3~6个月随访1次;之后每6个月1次进行全面检查,以便尽早发现肿瘤复发或转移。对于晚期或转移性胰腺癌患者,应至少每2~3个月随访1次。
7、结语
本共识力求简单实用、科学严谨,具有普遍适用性;偏重于临床实践,积极推荐多学科协作联合诊治模式。希望通过本共识的制定,能为广大临床医师提供工作参考。随着更多的高级别的临床研究进展和结果公布,专家委员会将及时对共识的内容进行更新和补充,以期不断提高我国胰腺癌的诊治水平。
主要执笔:王理伟 陈栋晖 李琦 楼文辉 夏廷毅 潘宏铭 王俭 张智弘 白永瑞
审阅专家:秦叔逵 赵玉沛 倪泉兴 蒋国梁
编写专家(按姓氏拼音排序):白永瑞 白玉贤 毕锋 陈栋晖 陈杰 傅德良 高勇 龚新雷 顾康生 郭伟剑 郝纯毅 华海清 蒋国梁 焦顺昌 李琦 梁后杰 梁军 刘宝瑞 刘文超 楼文辉 马冬 马清涌 倪泉兴 欧阳学农 潘宏铭 秦叔逵 沈琳 陶敏 万智勇 王成锋 王春刚 王俭 王杰军 王竞 王理伟 王立波 王耀 吴穷 夏廷毅 熊建萍 徐建明 徐农 徐玉清 杨建伟 殷咏梅 张灏 张俊 张太平 张涛 张阳 张智弘 郑磊贞
参考文献:(略)
我要评论






共0条评论