我的博文
新近认识的肾细胞癌

新近认识的肾细胞癌
Recently Identified Renal Cell Carcinoma
作者:赵明 滕晓东 孙柯 程亮
摘自《中华病理学杂志》2013年第7期
肾细胞癌(Renal Cell Carcinomas ,RCCs)是一组起源于不同节段肾小管上皮细胞的恶性肿瘤,无论在组织形态学、免疫表型和分子遗传学特征,还是生物学行为方面都具有明显的异质性。在过去的20多年中,RCC的组织学分类经历了多次演进。在1996年Heidelberg和1997年Rochester共识之后[1],通过整合大量的组织病理学,免疫组织化学及分子遗传学表现而形成了2004年WHO泌尿系统肿瘤病理学和遗传学分类 [2],该分类中最常见的肾细胞癌亚型依次为透明细胞性肾细胞癌,乳头状肾细胞癌(包括I型和II型)以及嫌色细胞性肾细胞癌,这三种亚型约占所有肾细胞癌的85-90%,其余约10-15%的肾细胞癌则包括一系列罕见类型(如粘液小管和梭形细胞癌,Xp11.2易位/TFE3基因融合性肾细胞癌,肾集合管癌,肾髓质癌,以及神经母细胞瘤相关性肾细胞癌等)和未分类的肾细胞癌以及某些家族性肾细胞癌。随着对肾细胞癌的发生学和分子遗传学研究的不断深入,以及新的分子生物学技术和免疫标记的不断进展,近年来发现了越来越多的具有独特临床病理学表现和分子遗传学特征的肾细胞癌,这些肾细胞癌尚未被收录在2004年的WHO分类中,其中某些可能代表了未被识别新的临床病理亚型或是已知肾细胞癌亚型的变异,如嗜酸细胞性乳头状肾细胞癌, 管状囊状肾细胞癌, 甲状腺滤泡样肾细胞癌, 血管平滑肌瘤样肾细胞癌, 与终末期肾疾病相关的肾细胞癌,透明细胞管乳头状肾细胞癌等。本文对这些新近认识的肾细胞癌亚型作一简要的阐述,着重介绍各自独特的临床病理学特征、免疫和分子表型,鉴别诊断及其生物学特性。
嗜酸细胞乳头状肾细胞癌
(Oncocytic Papillary Renal Cell Carcinoma,OPRCC)
绝大多数乳头状肾细胞癌可分为I型或II型[2]。在2005年,Lefevre M等[3]首先报道了乳头状肾细胞癌的第三种亚型,并称之为嗜酸细胞乳头状肾细胞癌。肿瘤特征为乳头状结构衬覆上皮胞浆丰富,呈颗粒状强嗜酸性。临床特征类似于其它类型的成年型肾细胞癌,肿瘤好发于男性患者(87%);发病年龄40-80岁(平均65岁)。大体上,肿瘤直径0.8-27cm(平均4.9cm), 瘤体界限清楚,切面呈棕黄色,但常见肿瘤内出血,即使在较小的病变亦是如此。
组织学上(图1,2),OPRCC瘤细胞呈乳头状和梁状排列。具纤维血管轴心的乳头被覆上皮胞质宽广,强嗜酸性;核浆比例通常相对较低。多数情况下核为圆形,偶尔显示不同程度的多形性;多数OPRCC无II型乳头状肾细胞癌中的复层化核[3,5],有亦为局灶存在;[6,7]核往往倾向分布于细胞的腔面而非基底部[3,5]。核级别不定,约1/3为高核级(通常为3级)[3-6]。超微结构显示肿瘤细胞内充满线粒体嵴[5,7]。部分病例中,在乳头轴心或间质可见单个或簇状聚集的泡沫状组织细胞,偶见沙砾体形成;坏死较常见[3,5,6]。最近,Mai等[7]报道了一组伴有实性成分的OPRCC,识别其为OPRCC的依据包括存在泡沫状组织细胞,顿挫的乳头状结构和坏死,以及肿瘤细胞的免疫表型特征。
OPRCC瘤细胞的免疫表型,不同研究所报道的结果似乎有所不同。[3-6]但几乎所有的肿瘤均弥漫阳性表达CD10和AMACR;其它标记物的表达则多少不等:半数病例分别表达CK7,E-cadherin,Rcc maker; 约65%表达CK19,近60%表达波形蛋白。而EMA阴性或者仅为局灶表达。
在遗传学方面,OPRCC似乎与典型的乳头状肾细胞癌相似。FISH研究显示7号,17号染色体三体以及Y染色体丢失分别见于约70%,73%,33%的病例中[5,6]。
OPRCC的主要鉴别诊断包括嗜酸细胞腺瘤以及嫌色细胞肾细胞癌。尽管嗜酸细胞腺瘤中通常无乳头状结构,但OPRCC伴实性成分者可与之混淆。存在泡沫状巨噬细胞,泡沫状肿瘤细胞以及广泛的镜下坏死;同时瘤细胞免疫表达CD10,RCC Maker,AMACR以及Vimentin支持诊断OPRCC。此外,嗜酸细胞性嫌色细胞肾细胞癌通常至少含有小灶经典的嫌色细胞,同时嫌色细胞肾细胞癌往往不表达AMACR和Vimentin,而通常表达EMA.OPRCC与II型经典型乳头状肾细胞癌在形态上存在某些重叠。然而瘤细胞缺乏复层化的核可除外II型乳头状肾细胞癌;另外当OPRCC存在核复层排列时,鉴别主要取决于胞浆的体积;事实上,OPRCC与II型乳头状肾细胞癌可能是乳头状肾细胞癌中两种密切相关的形态学亚型。
关于OPRCC临床结局的报道还相当有限。事实上,所报道的病例中几乎所有的OPRCC在诊断时都局限于器官内,绝大多数为pT1期。仅有1例pT2期肿瘤在肾脏切除后复发而最终导致患者死亡,其余随访病例均无肿瘤复发及与之相关的死亡证据[3,5,6]。
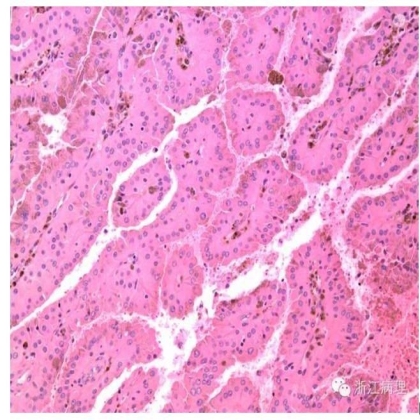
图1 嗜酸细胞乳头状肾细胞癌(OPRCC),肿瘤细胞呈乳头状排列,胞浆丰富,强嗜酸性,类似于嗜酸性细胞瘤样细胞。HE低倍放大
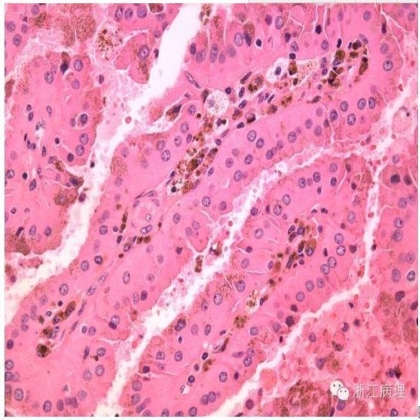
乳头具纤维血管轴心,间质内可见泡沫状组织细胞及含铁血黄素沉积。与II型乳头状肾细胞癌不同的是,OPRCC瘤细胞核倾向朝向腔面分布,核级别较低,无假复层排列。HE中倍放大
管状囊状肾细胞癌
(Tubulocystic Renal Cell Carcinoma,TCRCC)
管状囊状肾细胞癌是最近描述的一种肾细胞癌。过去文献中报道的与之形态类似的肿瘤被冠以各种不同的名称,包括“集合管上皮瘤”,低级别集合管癌等。2004年,Amin等[8]首先描述并根据其组织学特征命名为“肾管状囊状癌”。最近的系列报道详细阐述了管状囊状肾细胞癌独特的临床病理学特征及分子表型。[9-11]
TCRCC明显好发于成年男性(男/女约7:1),发病年龄范围从30至94岁。[9-11]多数患者常无症状,少数可有腹痛,血尿等症状。半数以上肿瘤位于左侧肾脏。[10,11]TCRCC大体上常为单侧孤立性,少数可为多灶发生;与周围组织分界清楚,但通常无包膜。肿瘤最大径0.5-17cm不等,平均约为4cm,大多数为pT1期肿瘤,少数可为pT2-3期。切面呈灰白色海绵状,含有通常不甚明显的小囊腔[10,11]。Zhou等[12]最近报道一组肾脏的管状囊状癌,其中20%(4/20)多灶发生,半数(10/20)与乳头状腺瘤或乳头状肾细胞癌共存。
镜下(图3,4),肿瘤由紧密排列的小管或直径达数毫米的囊腔组成,小管之间由温和的纤维性间质所分割;通常无实性生长方式;亦未见促纤维增生性反应或卵巢样间质。小管和囊腔被覆立方或柱状上皮,常见鞋钉样改变;瘤细胞胞浆丰富,嗜伊红或双嗜性。核大,通常可见明显核仁。少数瘤细胞核形态较温和,罕见的情况下以低级别核为主。少数可见透明细胞或乳头状结构。除非伴有乳头状肾细胞癌成分[11],肿瘤间质内常无泡沫细胞,砂粒体或含铁血黄素沉积。
免疫组化研究[9-11]显示肿瘤细胞一致性表达低分子量CK(CK8,CK18,CK19)以及微清蛋白(parvalbumin).超过90%的肿瘤表达CD10和AMACR,不同程度的表达CK7,常为弱或局灶表达。肿瘤同时还可表达kidney-specific cadherin(KSC)以及PAX2.但是通常不表达高分子量CK(34βE12).
电镜下多数肿瘤细胞含有丰富的微绒毛和刷状缘,类似于近曲小管上皮。少数瘤细胞可见短的,稀疏的微绒毛以及复杂的胞浆连接,类似于集合管的插入细胞[11]。
基因表达分析揭示了TCRCC独特的分子表型[10,11]。CGH显示管状囊状肾细胞癌与集合管癌两者之间存在明显的区别,提示TCRCC在遗传学方面与集合管癌无关[13]。某些研究者提出TCRCC可能与乳头状肾细胞癌有关,FISH分析表明两者均显示7,17号染色体获得以及Y染色体丢失[12],,而事实上如前所述,TCRCC可与乳头状肾细胞癌共存。
免疫组化标记以及电子显微镜观察提示肿瘤细胞表达异常的小管分化[11],但TCRCC的组织发生学目前还知之甚少。某些瘤细胞显示近端肾单位分化的特征,而另一些则可能与远端肾单位有关。但不支持TCRCC起源于集合管或Henle袢的假设[13]。令人感兴趣的是,TCRCC与乳头状肾细胞癌共存并不仅仅是一个偶然的现象;甚至在同一病变中两者可密切混合存在[11,12]。基于这样一个事实,以及重叠的免疫表型和分子遗传学特征,有理由认为TCRCC是乳头状肾细胞癌的一种形态学亚型。正如多房囊性肾细胞癌被认为是透明细胞性肾细胞癌的亚型一样。
TCRCC的鉴别诊断主要包括一系列的良性或恶性囊性肿瘤,如多房囊性肾细胞癌,囊性肾瘤,混合性上皮间质肿瘤以及囊性嗜酸细胞腺瘤等。多房囊性肾细胞癌上皮为透明细胞,核级别低,而且间隔内亦可见簇状聚集的透明细胞。而TCRCC常被覆嗜酸性细胞,核级别通常较高。TCRCC与囊性肾瘤均可见大小不等的囊肿以及被覆的鞋钉样细胞;但囊性肾瘤的瘤细胞通常核级别低,而且间隔常富于细胞;而TCRCC的间隔常为少细胞纤维性的。混合性上皮间质肿瘤典型的好发于中年女性,间隔常宽阔而且常见实性富于细胞性区域以及卵巢样间质,明显不同于TCRCC中的纤维性间质。嗜酸细胞腺瘤罕见的情况下可出现广泛的囊性变,但其构成细胞形态较温和,通常无核仁,与TCRCC中常见的高级别核特征不同;而且囊性嗜酸细胞腺瘤至少在局灶区可见典型的实性巢状嗜酸细胞伴疏松粘液样间质。
目前对于TCRCC生物学行为的报道还相对较少,有待进一步长期的随访研究。在已经报道的病例中,尽管大多数TCRCC表现为惰性的生物学行为,但仍有约10%出现局部淋巴结或远处的转移,包括骨和肝脏[11,12]。有意思的是,其中一例共存有TCRCC与乳头状肾细胞的患者,在转移灶内仅见乳头状肾细胞癌成分[11]。
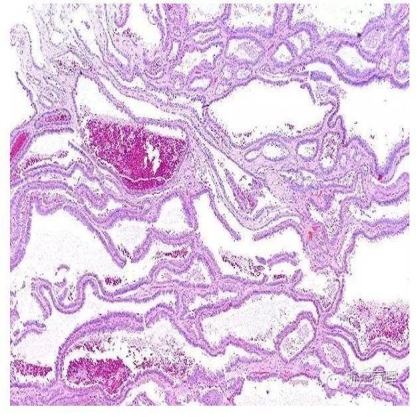
图3 管状囊状肾细胞癌(TCRCC),肿瘤由大小不等,形状不规则的小管状和囊状结构组成,间隔内见少量纤维性间质 HE低倍放大
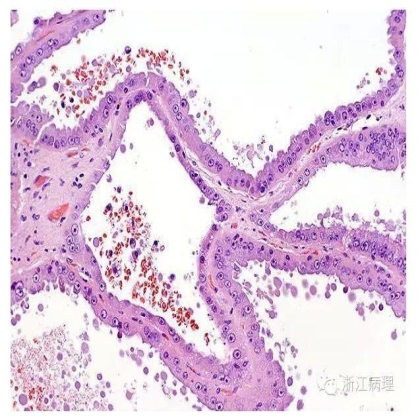
图4 小管或囊肿被覆单层立方上皮,瘤细胞胞浆丰富,双嗜性,某些呈鞋钉样表现,瘤细胞核级别高,可见明显的核仁 HE中倍放大
甲状腺滤泡样肾细胞癌
(Thyroid-like Follicular Renal CellCarcinoma,TLFRCC)
2004年,Amin等[14]以摘要的形式报道了4例形态学独特,类似于甲状腺滤泡癌的原发性肾实质肿瘤,并命名为甲状腺滤泡样肾细胞癌。到目前为止TLFRCC在文献中共报道了8例,其中女性5例,男性3例[15-17];发病年龄29-83岁(平均40岁);1例患者表现为间歇性肉眼血尿和右腹痛以及肺部转移性结节[17],其余7例均为偶然发现;肿瘤直径1.9-11.8(平均3cm),绝大多数发生于右肾(7/8),切面灰褐色,大体检查均未见肿瘤肾外扩散证据,1例因术前化疗显示广泛坏死及纤维化[17]。
显微镜下(图5,6),肿瘤与周围分界清楚,可见明显的假包膜。瘤细胞形成致密排列的微滤泡或巨滤泡样结构,肿瘤中50%以上的滤泡内含密集粉染的胶样物质。瘤细胞小,核级别低,可见核内包涵体以及核沟而更易与甲状腺肿瘤混淆;瘤细胞胞浆嗜酸性或双嗜性,未见透明细胞或乳头状结构。免疫组化检测,所报道的病例中1例表达PAX-8[17], 2例表达CK7。[15,17]仅1例表达CD10,[15]其余均不表达。6例不表达PAX-2,RCC Maker,WT1,CD56,CD57,AMACR。所有病例均不表达TTF1.遗传学分析1例肿瘤显示染色体8q24,12以及16获得,1p36.3,9q21.33缺失。[15]基因表达分析显示广泛的过表达或低表达,特别是涉及染色体1,2,3,5,6,10,11,16以及17[16]。1例肿瘤诊断时表现为双肺多发转移性肿瘤以及腹膜后淋巴结转移,放疗1年效果良好,无疾病进展而行根治性肾脏肿瘤切除,术后随访3月无殊。其余7例治疗后随访6-84月均无肿瘤证据[17]。
TLFRCC的主要鉴别诊断包括转移性甲状腺滤泡癌以及肾脏原发的起源于畸胎瘤的甲状腺癌。免疫组织化学染色TTF-1,TG以及密切的临床病理学联系对于鉴别这些形态学相似的肿瘤必不可少。
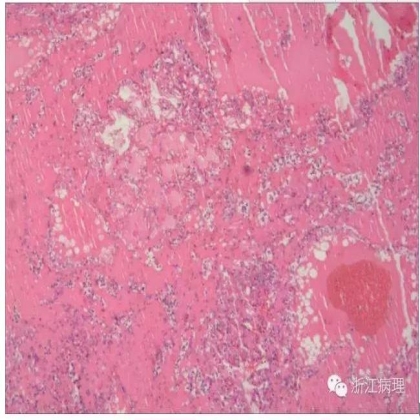
图5 甲状腺滤泡样肾细胞癌(TLFRCC),肿瘤由密集排列的大小不等的滤泡样结构组成,滤泡腔内可见多量嗜伊红物质沉积,并可见吸收空泡,类似于甲状腺滤泡癌 HE低倍放大

瘤细胞胞浆丰富,浅染;核级别低,可见核沟。HE 中倍放大
血管平滑肌瘤样肾细胞癌
(Angioleiomyomatous Renal Cell Carcinoma,ALRCC)
2006年,Kuhn等[18]描述了5例罕见类型的肾细胞癌伴有显著的血管平滑肌瘤样间质增生,并对以前文献中报道的4例肿瘤进行了复习。此后类似的肿瘤相继又报道了6例[19,20]。这些肿瘤曾被冠以不同的名称包肾脏括错构瘤,肾脏良性血管平滑肌腺瘤样肿瘤以及肾细胞癌伴显著的血管平滑肌瘤样增生。
ALRCC在发病性别,年龄方面与其它普通的肾细胞癌并无明显差异。多数病变为偶然发现,3例共存其它的恶性肿瘤(分别为乳腺癌,乳头状肾细胞癌以及结肠癌),1例与结节性硬化有关。
大体上,ALRCC肿瘤直径1.8-14cm不等(平均4.6cm),切面取决于血管平滑肌瘤样间质的多少表现为不同程度的黄褐色,棕色及灰白色混合;常见厚的纤维性包膜。显微镜下(图7,8),上皮性肿瘤细胞呈巢状,索状或实性片状排列,常见管状,乳头状结构。肿瘤细胞胞浆丰富而透明,核级别常较低。间质表现为数量多少不等的成熟的平滑肌增生,混有散在的常为扩张的血管腔;肿瘤的周边间质成分相对较丰富;有时间质增生扩散至临近肾实质甚或肾周脂肪组织内。
免疫组化,ALRCC肿瘤细胞表达CKAE1/AE3,CK7,Cam5.2,CD10,EMA以及Vimentin。局灶表达S100,不同程度的表达高分子角蛋白34βE12,但从不表达SMA和HMB45.间质成分表达α-SMA,H-caldesmon,Desmin以及Vimentin,不表达HMB45,CD117,CK,EMA,ER和PR等。2例肿瘤超微结构分析表明上皮成分具有类似于透明细胞性肾细胞癌的特征,而间质为典型的平滑肌细胞。
ALRCC遗传学分析结果不一致[19,20]。3例肿瘤FISH分析显示VHL及FHIT基因缺失,1例3号染色体缺失,另一例染色体3p缺失。另一组研究报道3例肿瘤均无3p缺失的证据。
ALRCC鉴别诊断包括透明细胞性肾细胞癌,血管平滑肌脂肪瘤伴发透明细胞性肾细胞癌以及肾细胞癌伴肉瘤样转化。如上所述,分子遗传学研究表明少数ALRCC显示3号染色体及3p丢失,类似于透明细胞性肾细胞癌,但与透明细胞性肾细胞癌不同,ALRCC肿瘤上皮细胞表达CK7以及34βE12。尽管ALPCC基于其独特的组织形态学和免疫表型特征而被视为一暂定的肾细胞癌实体,但其与透明细胞性肾细胞癌的关系有待于进一步的研究予以阐明。与肉瘤样肾细胞癌不同,ALRCC间质的血管平滑肌瘤样成分形态温和而且上皮与间质成分互相无融合。此外ALRCC中上皮和间质成分免疫组化均不表达黑色素标记物(HBM45)可与血管平滑肌脂肪瘤鉴别。
ALRCC预后方面的信息还相对有限。所报道的病例中,4例肿瘤在诊断时为pT1a及pT1b期;5例肿瘤平均随访3年(6个月-5年)均未见复发或转移的证据。
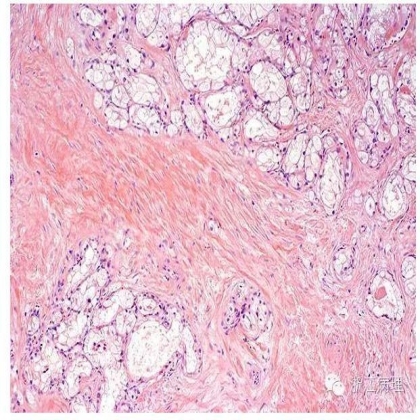
图7血管平滑肌瘤样肾细胞癌(ALRCC),肿瘤细胞呈腺泡状,巢状,索状包被于密集的平滑肌瘤样间质中 HE 低倍放大
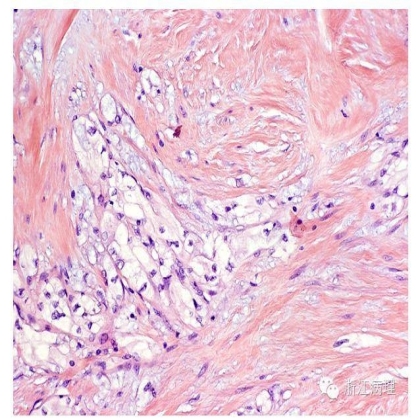
图8 瘤细胞胞浆透亮,核级别低,间质细胞致密,束状排列,强嗜酸性 HE 中倍放大
获得性囊性疾病相关的肾细胞癌
(AcquiredCystic Disease-associated Renal Cell Carcinoma,ACD-RCC)
越来越多的研究表明,患有终末期肾疾病(End-stage Renal Disease,ESRD)的患者罹患肾肿瘤的风险性明显增加。ESRD患者肾肿瘤的发病率约为普通人群的40倍。[21]ESRD相关的肾肿瘤谱系宽广,包括一系列类型不同的良恶性肿瘤[21,22],如透明细胞性肾细胞癌,乳头状肾细胞癌,嫌色细胞性肾细胞癌,集合管癌,管状囊状癌,血管平滑肌脂肪瘤,嗜酸细胞腺瘤以及混合性上皮间质肿瘤等,其中乳头状肾细胞癌相对最为常见(占18%)。近70%的患者在同一肾脏可发生多个不同的肿瘤[22]。
除了已知类型的肾肿瘤之外,最近发现2种与ESRD相关的类型独特的肾细胞癌[22],其中之一称之为获得性囊性疾病相关的肾细胞癌(Acquired Cystic Disease-associated Renal Cell Carcinoma,ACD-RCC),见于约46%的获得性囊性肾疾病中。另一种为透明细胞管乳头状肾细胞癌(见下所述)。ACD-RCC肿瘤通常较大,与邻近肾实质分界清楚,可见假包膜,包膜内常见营养不良性钙化。
显微镜下(图9,10),肿瘤细胞生长方式多样,可呈实性,腺泡状,乳头状或囊状排列。所有病例中均可见不规则的腔隙形成,类似于筛状结构。约67%的ACD-RCC似乎起源于先前存在的囊肿内。肿瘤细胞较大,胞浆宽阔嗜酸性,核圆形可见大核仁。某些瘤细胞可见胞浆内空泡形成,局灶可形成透明细胞。绝大多数肿瘤内可见特征性的草酸钙结晶;有时可伴钙盐沉积,但罕见砂粒体形成。
免疫组化,肿瘤细胞表达CKAE1/AE3,CD10,纽带蛋白(vinculin)以及AMACR.部分病例显示不同程度的局灶表达CK7以及微清蛋白(parvalbumin),不表达EMA以及高分子量CK(34βE12)[22]。
遗传学方面,1例类似于ACD-RCC的肿瘤显示7,17号染色体获得[23]。FISH分析2例肿瘤显示1,2,6号染色体获得[24]。但未发现VHL基因突变的证据[25]。
文献报道1例ACD-RCC患者随访34个月之后因转移而死亡,另外2例存在局部淋巴结转移[22]。
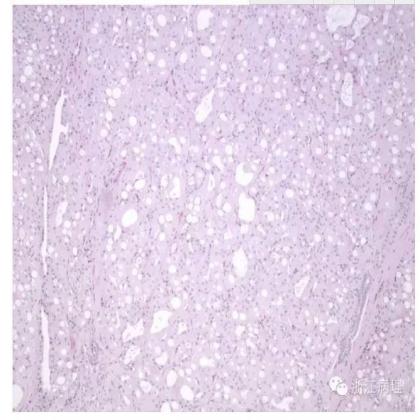
图9 获得性囊性疾病相关的肾细胞癌(ACD-RCC),肿瘤与终末期肾疾病相关,瘤细胞呈实性腺泡状弥漫排列,可见大量小而不规则的空腔形成,类似于筛状结构 HE 低倍放大
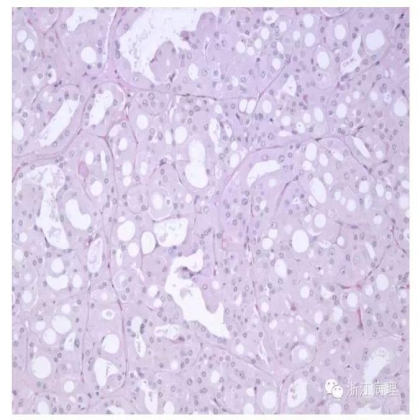
图10 瘤细胞胞浆丰富,嗜酸性,可见明显的胞浆内空泡形成;核圆,有时核仁显著 HE 中倍放大
透明细胞管乳头状肾细胞癌
(Clear Cell Tublo-Papillary Renal Cell Carcinoma,CCTPRCC)
透明细胞性管乳头状肾细胞癌(Clear Cell Tublo-Papillary Renal CellCarcinoma,CCTPRCC)最初被认为是一种独特的与ESRD相关的肾细胞癌,[22]但目前认为其在无ESRD的情况下也可发生[26-28]。
大体上,CCTPRCC肿瘤通常直径较小(<5cm),可多灶发生,特别是在ESRD的背景中更易多发。在同一肾脏中可能还同时存在其它类型的肾细胞癌。肿瘤具有厚的纤维性包膜,切面常为囊性或囊实性。
显微镜下(图11,12),肿瘤细胞显示多种生长方式,包括乳头状,分支管状以及实性腺泡状,巢状或缎带状等。乳头状和管状结构被覆上皮胞浆透明,核级别低。比较特征性的形态学特征为小管或乳头被覆的瘤细胞核常常远离基底部而朝向腔面分布,产生特征性的核下空泡而类似于分泌期子宫内膜,但该特征并不是在所有肿瘤中都存在。腔内或囊内常见分泌性蛋白液聚集。间质内无泡沫状组织细胞及含铁血黄素沉积,无砂粒体形成。缺乏侵袭性的组织学特征如肾窦浸润,血管累犯,坏死及核多形性等。
CCTPRCC具有特征性的免疫表型,显示与透明细胞性肾细胞癌和乳头状肾细胞癌的部分重叠。肿瘤细胞弥漫表达CAIX,但不表达CD10,此与透明细胞性肾细胞癌不同.CAIX常表达于肿瘤细胞的基底部,而腔面不表达,产生某种特征性的“杯状”着色模式[29]。同时,CCTPRCC弥漫表达CK7,但不表达AMACR,此与乳头状肾细胞癌不同。肿瘤细胞不表达TFE3与组织蛋白酶K,此与TFE3易位的肾细胞癌不同。同时,肿瘤斑驳状表达高分子量角蛋白(34βE12)亦有助于鉴别诊断。
细胞和分子遗传学方面,CCTPRCC通常无透明细胞性肾细胞癌的3p缺失以及乳头状肾细胞癌的7,17染色体三体[26,27]。同样也无VHL基因突变和启动子甲基化[27]。然而最近一项研究表明[30], CCTPRCC除了表达CAIX之外,常显示HIF活化路径的其它免疫标记物的过表达。虽然已经证实CCTPRCC无VHL基因突变或拷贝数的异常;但VHLmRNA却往往呈过表达。表明CCTPRCC中HIF是通过非VHL依赖的机制而活化的[30]。最近,Adam等利用CGH研究7例CCTPRCC均未检测到任何染色体失衡[28]。
CCTPRCC的主要鉴别诊断包括TFE3易位的肾细胞癌[29]。后者常见透明细胞及乳头状结构易与CCTPRCC混淆;与CCTPRCC不同的是,易位性肾细胞癌少见围绕乳头的囊肿,瘤细胞常胞浆丰富嗜酸性或透明,核级别高,常见坏死和砂粒体形成;无CCTPRCC特征性的核下空泡。而易位性肾细胞癌免疫组化特征性的核表达TFE3可明确区分两者。此外,CCTPRCC免疫组化表达CK7,CAIX,不表达AMACR,CD10,遗传学分析无7,17染色体三体和3p缺失可分别与透明细胞性肾细胞癌和乳头状肾细胞癌鉴别。
尽管文献中关于CCTPRCC临床结局的资料还相当有限,但现有证据表明其为生物学行为惰性的肿瘤,大多数的CCTPRCC在诊断时局限于肾实质内。Aydin等[27]所报道的一组病例以及复习文献中有随访资料的病例显示,40例患者在平均随访28个月后均未见肿瘤复发的证据。
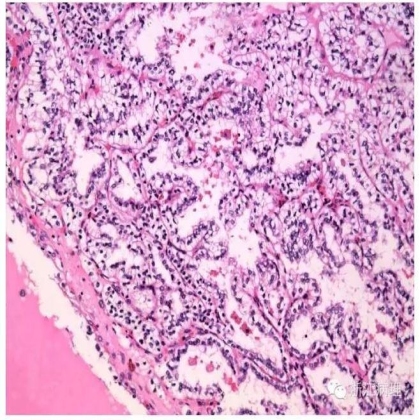
图11 透明细胞性管乳头状肾细胞癌(CCTPRCC),肿瘤呈复杂分支乳头状,腺泡状排列,乳头可见纤细的纤维血管轴心。HE 低倍放大
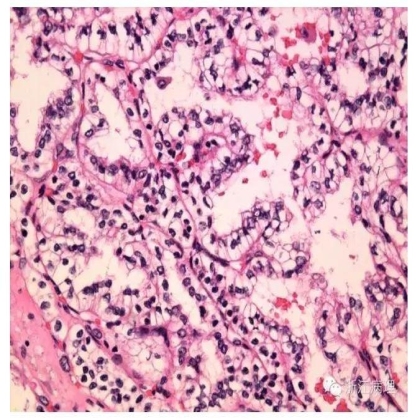
图 12 乳头被覆上皮胞浆透明,核级别低,朝向腔面分布,产生特征性的核下空泡,类似于分泌期子宫内膜。 HE 中倍放大
参考文献(略)
我要评论




共0条评论