我的博文
通路 | TGF-β:诱导EMT最重要的因子
TGF-β有着多种多样的功能,这次我就着重跟大家聊一聊其在上皮-间质转换(epithelial–mesenchymal transitions,EMT)中的作用。EMT可是与肿瘤的发生和侵袭转移密切相关的过程。对于不熟悉EMT的朋友,我先给大家一个背景知识速览:
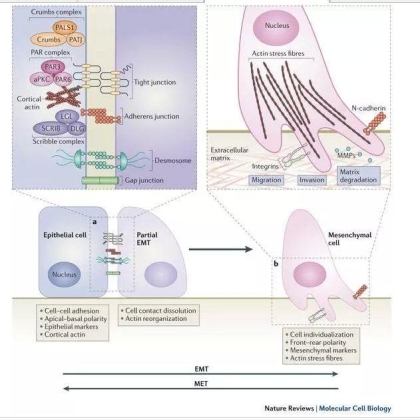


生理状况:
上皮细胞-间质细胞转换在胚胎发育过程中具有十分重要的地位。在胚胎发育过程中出现最早的EMT转换是在原肠胚形成期时发生的间质细胞形成和中胚层形成事件。胎盘、前体节、心脏瓣膜、神经管嵴、泌尿生殖系统、继发腭等组织器官的形成过程以及胚胎多个器官的分支形成过程中都有EMT和MET转换作用的参与。
正常组织在受损的情况下,也会在损伤部位的上皮细胞发生EMT的转化,从而完成损伤修复过程。
病理状况:
EMT被认为是纤维化疾病的一个重要成因。
在肿瘤的发生发展过程中EMT也起到了非常重要的作用。EMT可促进肿瘤细胞的浸润以及肿瘤的转移, 还可能使肿瘤细胞逃逸某些因素诱导的凋亡。越来越多的数据表明该过程在调控正常人体组织和肿瘤组织的细胞可塑性(cellular plasticity)方面也起到了关键作用。通过EMT能够形成多个各不相同的细胞亚群,即形成了肿瘤细胞异质性(intratumoural heterogeneity)。而这些特征又都与肿瘤相关表型,比如肿瘤转移或致死率等有关,因此,如何针对肿瘤细胞的这种干细胞特征(即可塑性)来设计治疗方案、寻找治疗药物已经成为了临床研究中的一大热点。
然而整个EMT的过程是相当复杂的,EMT可以通过多种信号通路激发,并且可以与胞内的EMT下游信号通路中参与该过程的转录因子共同组成一个复杂又意义重大、包含有多个正反馈回路的信号网络。这个复杂的相互作用网络确保了细胞在EMT转换后所获得的间质细胞表型能够稳定的表达。
参与EMT过程控制的信号通路有:
酪氨酸激酶受体(Receptor tyrosine kinases,RTK)
转化生长因子-β(TGF-β)
Notch蛋白
内皮素A受体(endothelin A receptor,ETAR)
整联蛋白(integrin)
Wnt蛋白
缺氧以及基质金属蛋白酶(matrix metalloproteinase,MMP)等。
另外,细胞外基质的重构也能触发EMT过程,因为很多诱发EMT的因子都能上调细胞外基质蛋白(比如纤维连接蛋白fibronectin和胶原蛋白collagens)、蛋白酶(比如MMP)以及其他一些重构酶(比如赖氨酸氧化酶lysyl oxidase)的表达水平。除了各种信号通路之间的相互作用之外,促进EMT过程的细胞因子(图中紫色圆圈表示转录因子)和miRNA之间也存在着非常复杂的相互调控作用。
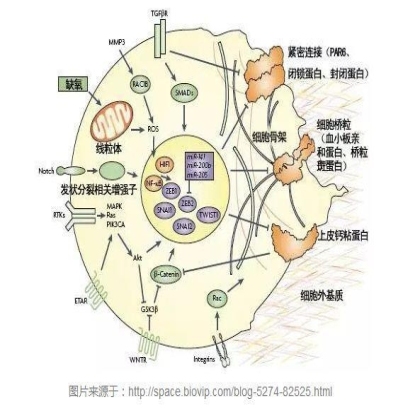
由于EMT涉及的信号通路众多,这一次我先就TGF-β介导的EMT给大家做个介绍:TGF-β被认为是在发育过程、癌症以及其他病理状态下诱导EMT最重要的因子。在一些体外培养的上皮细胞系中,单纯的TGF-β刺激就可以诱发EMT。在TGF-β信号介导EMT可以通过经典的Smad通路实现,也可以通过非Smad通路发生。
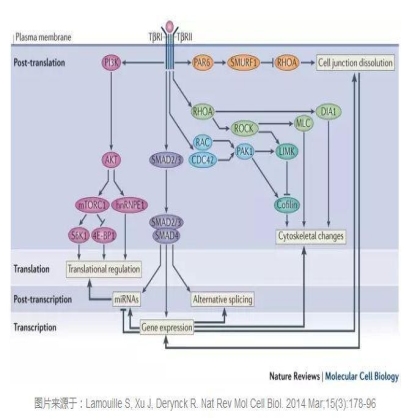
在经典的smad通路中,TGF-β信号将通过一个四聚体复合物I型和II型受体(TbRI和TbRII)激活Smad2和Smad3,并与Smad4结合。而Smad复合物将转移到细胞核内与转录因子一起介导靶基因的抑制或激活。同时,Smad复合物也可以在细胞核诱导miRNA的表达,从而抑制上皮细胞的标志性蛋白表达,促进间充质细胞特性的蛋白表达,从而促进EMT。
在TGF-β信号介导的非Smad信号通路中,它可以激活PI3K-AKT-mTOR信号进行转录调控,而活化的AKT也可以通过抑制核糖核蛋白E1(hnrnpe1)进行转录调控从而达到触发EMT的效果。另一方面,TGF-β将通过调控细胞骨架的变化,调节Rho GTPase使其泛素化和降解,从而降低细胞间的紧密连接。TGF-β同时也可以调控RhoA的活性,促进Rho相关激酶(ROCK)和磷酸化肌球蛋白轻链(MLC)对LIM激酶(LIMK)激活从而抑制cofilin。Rac和Cdc42也参与了TGF-b信号介导的非Smad信号通路,TGF-β刺激导致的细胞骨架的变化通过p21活化激酶1(PAK1)和直接的片状伪足和丝状伪足的形成。这些都是已报道过的TGF-β介导的非Smad信号通路。TGF-β还能影响其它多个EMT触发信号途径的活性,比如Notch、Wnt以及整联蛋白信号通路等。
上面介绍的都是经过科研人员的大量努力,给大家呈现的EMT背后的一些分子机制,也证明了它们对于临床肿瘤患者的重要意义,但是要根据EMT机制开发出相应有效的抗癌疗法,还有很多问题需要科研工作者在今后的工作中一一解决。
我要评论




共0条评论