我的博文
荧光原位杂交(FISH)样本处理标准方案系列(二)——常规细胞学样本

诊断细胞学是是病理学的一个重要组成部分,结合运用化学、生物化学、分子生物学技术对细胞内各种不同的靶标进行检测,从而达到定性及半定量分析。FISH技术广泛应用于多学科领域的研究中,在临床细胞学诊断领域更是不可缺少的重要辅助工具,例如,慢性粒细胞白血病骨髓和外周血中BCR/ABL融合基因检测、膀胱癌尿脱落细胞3、7、17号染色体数目及P16基因状态分析、产前及流产羊水细胞或绒毛细胞样本中对13、16、18、21、22、X和Y染色体数目异常检测等。
细胞学多种类样本的处理中,常因缺少标准操作规范,导致实验结果失败,无法诊断,给临床工作带来不便。本篇对临床中常见细胞学样本的处理操作进行整理、归纳,提出适用于大多数细胞学样本的FISH处理标准方案,赶快阅读、收藏吧!
一、样本制备
样本制备的质量是细胞学FISH诊断成败的基础,必须注意!
1、低渗——样本质量的关键
低渗处理凭借反渗透作用使细胞膨胀、染色体铺展,同时可使粘附于染色体的核仁物质散开,以便能在一个平面上观察所有染色体形态。实验室中一般选用0.075M KCl为低渗液。由于不同类型样本的核浆比不同,对低渗的要求也有所不同,如骨髓/外周血的细胞核占的比例高,低渗时间可以短一些,一般建议低渗时间20分钟;尿脱落细胞/羊水细胞/宫颈脱落细胞的核浆比很小,低渗时间相对需要延长,一般建议低渗时间30分钟。
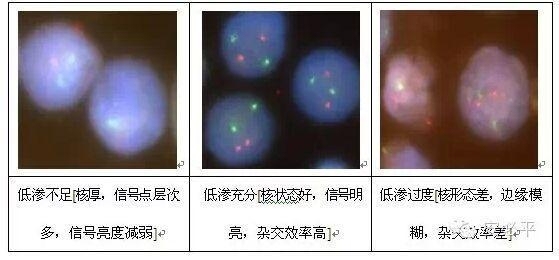
样本需要进行充分低渗,但是避免低渗不足或者过度。低渗是否充分对FISH检测结果影响非常明显,对于低渗不足的样本,后续可以尝试延长消化时间,改善结果,但是对于低渗严重过度的样本,FISH结果几乎不可逆。
示例:
小编提点:
低渗过程要轻柔,避免太大外力导致细胞核破碎。
高速离心时的离心力会破坏细胞形态,推荐离心转速为2000~3000rpm。
小编推荐:
根据不同样本类型,初次试验时可以设置低渗梯度,例如:10min、15min、20min,杂交后镜下观察,选择最适时间进行低渗处理。
2、预固定
在完成样本的低渗后,需要加入固定液进行预固定。低渗后细胞核膨胀,比较最脆弱,进行预固定时,小心缓慢加入固定液。卡诺氏固定液(3:1 =甲醇:冰醋酸)是常使用的细胞固定液,适用于一般组织和细胞的固定,有极快的渗透力,能迅速穿透细胞,将其固定并维持染色体结构的完整性。通常使用室温或低温。因甲醇与冰醋酸(乙酸)能反应生成乙酸甲酯,所以要现配现用。
小编推荐:
卡诺氏固定液(3:1 =甲醇:冰醋酸)预固定10分钟对于FISH后续处理效果将更有益。
3、滴片
质量好的细胞滴片应具备:细胞密度及数目适当,分布均匀。密度过高的滴片细胞互相重叠;密度过低的滴片,细胞量少,均难以做出准确的诊断。当遇到标本细胞严重聚集成团,细胞碎屑或杂质过多(可自发荧光,造成强背景)时,则需要低渗前使用胰酶或胶原酶进一步处理(常用于尿脱落细胞、羊水细胞),使细胞分布更均匀,滴片背景更干净。

小编推荐:
在相差显微镜下观察细胞密度,单视野细胞数量在100~200个为宜。
二、样本处理
细胞片制备完毕,接下来进行样本处理。
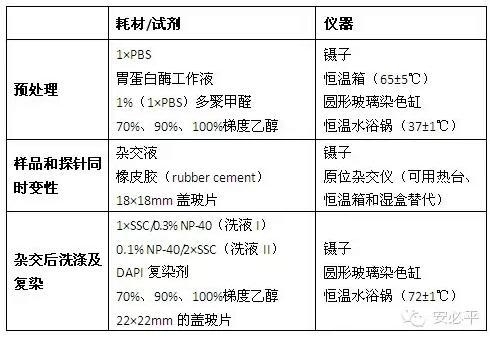
2、操作流程:
(1)预处理:

小编提点:
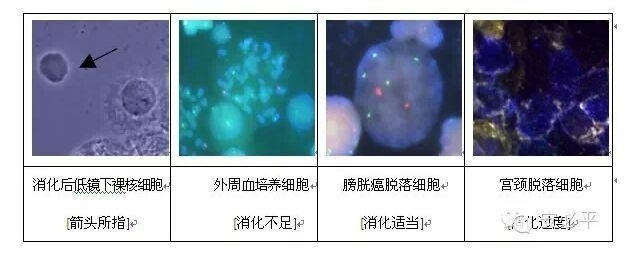
1) 酶消化:除去细胞膜表面的蛋白质、脂类等物质,充分暴露细胞核。如果消化不足(酶浓度低、温度不适合、时间太短),镜下出现云雾状覆盖在细胞上,形成中间较厚、四周较薄的荷包蛋样细胞,独立的细胞核无法暴露,从而降低杂交效率并难以选择细胞进行计数;如果消化过度,则细胞核被损伤,失去正常的圆形完整形状,甚至形成“鬼影”状细胞,核物质丢失,杂交信号弱甚至无杂交信号,无法判断结果。
2) 1%(1×PBS)多聚甲醛固定:能保护细胞核结构,最大限度保持细胞核内DNA的水平,是细胞消化后最常用的固定液。
小编推荐:
预处理快速法:2×SSC洗涤5min,70%、90%、100%梯度乙醇各3min,晾干。适用于新鲜未培养的骨髓或外周血样本,操作更简单、快速。
(2)杂交:

变性,是利用高温将标记的荧光探针和样本内的DNA双链均变成单链,低温时两者依据碱基互补配对原则结合。变性温度不准确或者时间不充足,探针和靶DNA未能充分打开,导致杂交效率低、信号弱甚至杂交失败;
小编提点:
必需确保变性温度准确、恒定且时间充足;37℃杂交反应的最佳时间为10~18小时。
(3)洗涤:撕去封片胶,揭去盖玻片

小编提点:
杂交后洗涤是为了消除一切影响结果判读的因素(如未杂交的探针、非特异的杂交信号和高背景等),确保诊断更可靠,因此必须充分洗涤。
(4)复染:滴加10μl DAPI复染剂至干燥的盖玻片上,反转样本片,使盖玻片分别与载玻片的目标区域接触,反转后轻压,避免产生气泡,在暗处存放,待观察。
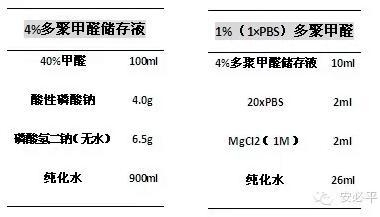
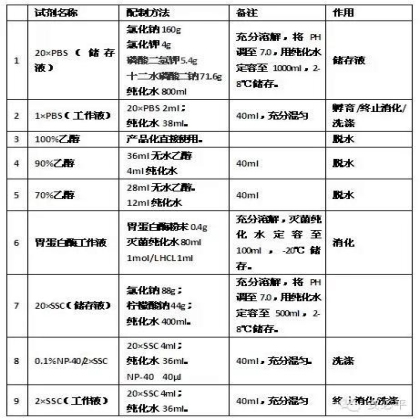
附录:主要试剂配制表:
我要评论




共0条评论