我的博文
非小细胞肺癌免疫组化标志物专家共识(2014)
非小细胞肺癌(non small cell lung carcinoma, NSCLC)占所有肺癌的80%,可以分为不同的组织学类型,主要包括腺癌(≥40%)和鳞癌(30%),以及较为少见的大细胞癌(large cell carcinoma, LCC)(10%)。随着肺腺癌和鳞癌个体化治疗方案的日趋不同,临床强烈要求对不同组织学类型的NSCLC明确诊断。对于绝大多数手术切除病例而言,经充分取材均能够正确诊断,但病理医师在实际工作中经常面临的是小活检标本(占70%)的诊断,此时有效的免疫标志物在辅助诊断和鉴别诊断中尤显重要。免疫标志物的重要性不仅体现在NSCLC不同组织学类型之间的诊断和鉴别诊断,肺原发癌与诸多类型转移癌之间的鉴别诊断,还在于明确特征性的分子学改变(如EGFR、EML4-ALK),用于满足NSCLC个体化治疗和预后判断的需要。在越来越多的免疫标志物中,如何选择简单而有效的抗体(组合)达到对NSCLC,特别是小活检标本的病理诊断和鉴别诊断目的,本文综合国内外权威文献形成以下共识。
1 NSCLC常用免疫标志物
1.1 肺腺癌常用免疫标志物
1.1.1 TTF-1 TTF-1是肺腺癌最常用的免疫标志物之一,75%~85%的肺腺癌表达TTF-1,且常呈弥漫一致性的强阳性,约20%的肺腺癌不表达TTF-1[1-3]。TTF-1在肺腺癌中的表达与分化程度和组织学类型有关,总体而言,肿瘤分化程度越差,TTF-1越可能表达缺失,具有Ⅱ型肺泡上皮细胞/Calar细胞特征的腺癌几乎全部表达TTF-1,泌黏液性腺癌(浸润性黏液腺癌、胶样腺癌等)呈不同程度表达(表1)[4-6]。TTF-1也表达于肺神经内分泌肿瘤(neuroendocrine tumors, NETs)、部分典型类癌(typical carcinoid, TC)、非典型类癌(atypical carcinoid, AC)、约50%的大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC)及90%的小细胞肺癌(small cell lung carcinoma, SCLC)[7-9]。通常认为肺鳞癌不表达TTF-1[10]。因此,TTF-1主要用于肺腺癌和鳞癌的鉴别,不能鉴别肺腺癌和肺NETs。在非肺源性肿瘤中,除了甲状腺癌几乎全部表达TTF-1以外,少量子宫内膜、子宫颈、卵巢、乳腺和结直肠的腺癌也表达TTF-1[11-15]。与NapsinA不同,所有类型的肾细胞癌(renal cell carcinoma, RCC)均不表达TTF-1[16,17]。
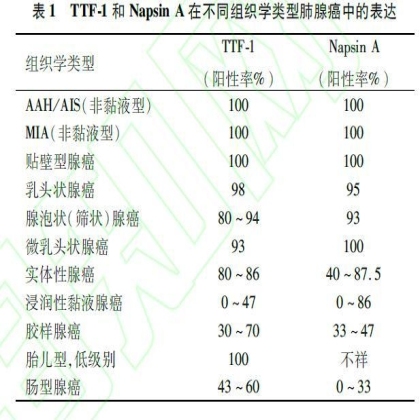
1.1.2 NapsinA NapsinA也是肺腺癌最常用的免疫标志物之一,70%~90%的肺腺癌表达NapsinA,其敏感度和特异度均优于TTF-1,TTF-1和NapsinA是目前诊断肺腺癌最优秀的抗体组合之一[18,19]。与其他Ⅱ型肺泡标志物(TTF-1、细胞表面糖蛋白)相似,NapsinA在肺腺癌中表达也与组织学类型、分化程度具有相关性(表1)[16,20,21]。约3%的肺鳞癌表达NapsinA,肺NETs不表达NapsinA,因此可以用于肺腺癌和NETs的鉴别诊断[18,22,23]。值得注意的是,正常肾组织表达NapsinA,高达80%乳头状RCC和34%的透明细胞RCC表达NapsinA[16,24,25]。部分女性生殖系统来源的腺癌表达NapsinA,见于约7%的卵巢腺癌和15%的子宫内膜腺癌,其中高达2/3的透明细胞腺癌表达NapsinA[26-28]。其他组织器官发生的小部分腺癌也表达NapsinA,如甲状腺的乳头状癌和差分化(间变性)癌、胆管细胞癌等[16,29-31]。
1.1.3 CK7 几乎100%的肺腺癌均表达CK7,极高的敏感度使CK7成为肺腺癌诊断和鉴别诊断最常用的抗体之一,特别是在鉴别肺原发性腺癌和转移性结直肠腺癌时,CK7常作为首选的抗体组合成员。但CK7的特异性较低,30%~60%的肺鳞癌表达CK7。在非肺源性腺癌中,CK7表达广泛见于乳腺、胃、卵巢、胰腺、子宫、尿路上皮等多种器官和部位发生的腺癌,因此,在肺腺癌鉴别诊断时,需与其他特异度较高的抗体(TTF-1、NapsinA)联合应用。
1.1.4 肺泡表面糖蛋白(SP-A、SP-B) SP-A、SP-B仅表达于约50%的肺腺癌。其表达的组织学谱系较窄,主要见于分化程度较高的具有Ⅱ型肺泡上皮细胞/Calar细胞分化特征的腺癌,在差分化肺腺癌常常表达缺失,对于起源于较大支气管、具有杯状细胞特征的腺癌(浸润性黏液腺癌、胶样腺癌等),肺泡表面糖蛋白几乎无诊断价值。
1.1.5 Cam5.2 Cam5.2是常用的低分子量角蛋白,包括CK8和CK18。几乎100%的肺腺癌表达Cam5.2,约35%的肺鳞癌和20%的肺LCC也表达Cam5.2。此外,Cam5.2可表达于人体几乎所有类型的腺癌,特异性较低使Cam5.2在肺腺癌诊断和鉴别诊断中的应用价值均非常有限。
1.2 肺鳞癌常用免疫标志物
1.2.1 p63及ΔNp63(p40) p63和p40是肺鳞癌最常用的免疫标志物。高于90%的肺鳞癌p63呈强烈核表达,一般认为p63在肺腺癌中的阳性率为10%~33%,且常常呈局灶性低水平表达。p63诊断肺鳞癌的敏感度高达97.4%,但特异度较低,仅有72.8%。相当比例的肺非鳞癌表达p63,肺NETs不同程度表达p63,在TC和AC中p63不表达或呈较低水平(6%)表达,p63在13.5%~18%的LCNEC以及约22%的SCLC中表达[32,33]。p40的敏感度与p63相似,但特异度优于p63,高达96.8%的肺鳞癌均强表达p40,仅在3%~5%的腺癌中表达,且常呈局灶阳性(<5%)表达[34,35]。肺NETs中,p40不表达于肺类癌,仅在3.6%的LCNEC中表
达。此外,2.4%的间皮瘤表达p40。
1.2.2 CK5/6 CK5/6是肺鳞癌最常用的免疫标志物之一,75%~100%的肺鳞癌表达CK5/6,其表达与鳞癌的分化、分级无关,但也有研究显示,20%的低分化鳞癌不表达或仅低表达。2%~33%的肺腺癌可表达CK5/6,但常呈局灶性低水平表达。75%~100%的胸膜上皮样恶性间皮瘤也表达CK5/6,联合应用其他特异性间皮瘤标志物有助于二者的鉴别诊断。CK5/6与DSG3组合可以诊断92.6%的鳞癌。在p63不表达的情况下,单一的CK5/6表达并不足于支持鳞癌的诊断。
1.2.3 CK34βE12 几乎100%的肺鳞癌均表达CK34βE12 ,但高达89%的肺腺癌同样表达 CK34βE12 ,与p63、p40比较 CK34βE12 特异性低且敏感性并无优势,因此不作为一线抗体使用。
DSG3新近被广泛应用于肺腺癌和鳞癌的鉴别诊断,85%~90%的肺鳞癌表达DSG3,其几乎不表达于肺腺癌(<< p="">
2%)[36]。DSG3和NapsinA鸡尾酒抗体能区别85%以上的肺腺癌和鳞癌[37]。其他上皮性标志物如MOC-31、CEA、COX-2等在肺鳞癌和腺癌鉴别诊断中的作用价值非常有限且意义不大。
1.3 肺NETs常用免疫标志物(本共识除外SCLC) 肺NETs占所有肺恶性肿瘤的20%~25%,包括TC、AC、LCNEC和SCLC,TC、AC和SCLC的诊断主要依靠形态学特征,而LCNEC的诊断则常需要结合免疫标志物。CgA、Syn和CD56是最常用的神经内分泌标志物组合,其中CgA的特异性最强。41%~75%的LCNEC表达TTF-1,约60%的LCNEC表达CK7。Ki-67增殖指数对肺NETs具有诊断和分级双重意义,TC的Ki-67增殖指数≤5%,属于低级别NETs,AC为5%~20%,属于中级别NETs,LCNEC通常≥60%,属于高级别NETs。LCNEC的诊断除依靠形态学特征,还需结合免疫组化标记或电镜检查证实神经内分泌。
2 免疫标志物在NSCLC诊断和鉴别诊断中的应用
p63(p40)是目前鉴别肺腺癌和鳞癌最常用的抗体组合之一[38,39]。鉴于p63在10%~33%的肺腺癌中呈局灶性低表达,因此在判断p63染色结果时,仅弥漫性强表达于胞核时才能判读为阳性。同样对于CK5/6,只有弥漫强表达时才能判断为阳性(弥漫性表达定义为" 50%的肿瘤细胞表达)。通常TTF-1/p63组合在腺癌和鳞癌均是一个阳性而另一个阴性,如果TTF-1/p63均阳性,倾向于诊断腺癌,因为p63可以在腺癌中表达而TTF-1几乎不在鳞癌中弥漫表达;如果TTF-1/p63均阴性,则仍然怀疑腺癌,因为TTF-1在差分化腺癌中缺失表达的现象较常见,而p63在鳞癌中的表达非常稳定,一些所谓“p63阴性的低分化鳞癌”其实可能是实体性腺
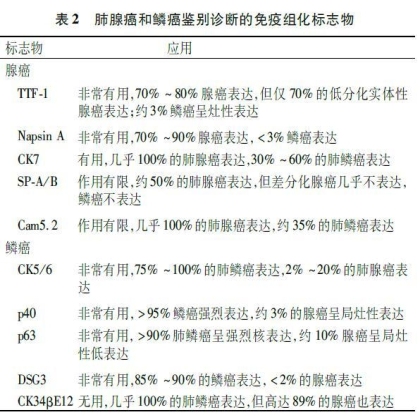
癌;但TTF-1/p63双阴性也可见于其他类型腺癌。所有鳞癌标志物均不能鉴别转移性鳞癌、肌上皮癌、尿路上皮癌、上皮样恶性间皮瘤,甚至包括肉瘤和大细胞淋巴瘤。p63在部分大细胞淋巴瘤(间变性大细胞淋巴瘤、弥漫性大B细胞淋巴瘤等)中表达,而p40在上述大细胞淋巴瘤中不表达,因此选择p40代替p63能有效避免将肺或纵隔的大细胞淋巴瘤误诊为鳞癌(表2)。
2.2 肺腺癌与硬化性肺细胞癌(sclerosing pneumocytoma)的鉴别诊断 硬化性肺细胞瘤由两型细胞组成:表面细胞和上皮圆形细胞,两型细胞均可能起源于呼吸道多潜能原始上皮细胞,具有Ⅱ型肺泡上皮的分化特征,因此表达Ⅱ型肺泡上皮细胞的免疫标志物,如TTF-1、NapsinA等。但与肺腺癌弥漫一致性表达上述指标有所不同,硬化性肺细胞瘤两型细胞之间的表达模式有明显的特征。90%~100%的硬化性肺细胞瘤两型细胞均表达TTF-1,但与表面细胞比较,圆细胞的染色强度稍弱。表面细胞弥漫一致性表达NapsinA、CKpan、CK7和肺泡表面糖蛋白,大部分表达Cam5.2;而圆细胞不表达CKpan和肺泡表面糖蛋白,不表达或仅呈局灶性弱
表达NapsinA,仅31%的病例表达CK7,17%的病例表达Cam5.2。除此之外,圆细胞通常一致性表达Vimentin。需注意的是,上述指标的表达模式只有在手术切除标本中才能充分显现,对于小活检标本,免疫标志物对于鉴别硬化性肺细胞瘤和低级别腺癌非常困难。
2.3 肺原发性癌与转移性肿瘤的鉴别诊断
2.3.1 肺腺癌与转移性腺癌的鉴别诊断 肺是多种类型癌转移最常见的部位之一,其中腺癌可能来自胃肠道、乳腺、卵巢、子宫内膜和前列腺等器官,未知原发部位的转移性腺癌占所有肺癌的3%~5%。鳞癌可能来自食管、头颈部、皮肤等部位,其他还包括膀胱等泌尿系统的尿路上皮癌。目前尚无有效的标志物(组合)将肺原发性鳞癌与转移性鳞癌鉴别开来。一些腺癌转移至肺脏时仍然表达“器官特异性”的标志物,借助有效的抗体组合可以进行鉴别诊断。
肺腺癌常常需要与转移性结直肠腺癌鉴别,对于大部分肺腺癌,特别是具有Ⅱ型肺泡上皮细胞/Calar细胞特征的腺癌,利用肺腺癌特异性的标志物如CK7TTF-1和NapsinA,以及肠癌特异性标志物如CK20、CDX2等易与转移性结直肠癌鉴别诊断。但部分肺腺癌可表达“肠型”标志物(CK20、CDX2),其中约8%的肺腺癌表达CK20,12%的肺腺癌表达CDX2。这类腺癌的主要特征是产生细胞内/外黏液,组织学类型包括黏液腺癌(黏液性BAC)、胶样腺癌、肠型腺癌以及部分腺泡/筛状为主型腺癌,如50%~90%的黏液腺癌表达CK20,且常常伴CDX2的表达。形态学上该类腺癌具有结直肠腺癌的特征,“肺型”标记呈不同程度的表达(表1),使这
类腺癌与肺内转移性结直肠的鉴别诊断具有挑战性。除了常规应用免疫标志物组合以外,应综合病史、临床表现以及内镜和影像学资料进行考虑,以下表现支持泌黏液性肺腺癌的诊断:(1)临床以肺癌为首发症状,无结直肠癌病史及相关临床表现;(2)内镜和影像学检查除外结直肠肿瘤;(3)组织学除了“肠型”腺癌的特征外,还具有经典“肺型”腺癌的成分如贴壁生长、乳头或腺泡成分;(4)表达“肺型”标记如CK7、TTF-1或NapsinA等。
除了结直肠腺癌外,转移至肺的腺癌还可能来源于乳腺、肾脏、卵巢、前列腺等远位器官。乳腺癌大部分表达ER/PR、GATA-3、囊泡病液体蛋白15(gross cystic disease fluid protein 15, GCDFP15)或者乳腺球蛋白(Mammaglobin)。GATA-3是乳腺癌的特异性标志物,在47%~100%的乳腺癌中表达,其中90%以上的腺腔型乳腺癌表达GATA-3,但在三阴性乳腺癌中的阳性率较低(40%)。肺腺癌不表达GATA-3,但部分东亚裔肺腺癌表达ER,因此,鉴别诊断时需结合TTF-1和NapsinA。肺腺癌不表达Pax-8,因此Pax-8表达强烈支持为转移性腺癌[40]。RCC强烈表达Pax-8,结合Pax-2及其标志物有助于诊断RCC;Pax-8、ER和PR表达则支持卵巢浆液性腺癌的诊断;Pax-8、TG表达有助于甲状腺癌的诊断;PAS和PASP表达则强烈支持前列腺癌的诊断。
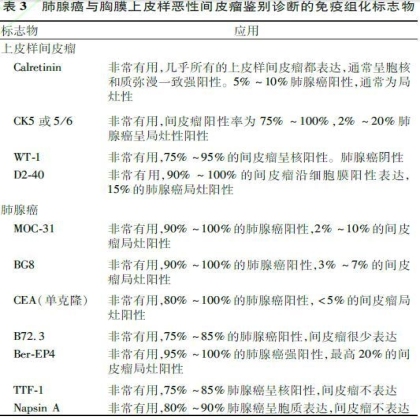
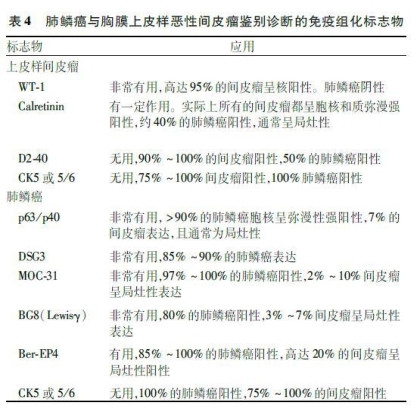
2.3.2 肺癌与胸膜上皮样恶性间皮瘤的鉴别诊断 肺腺癌和鳞癌有时需与胸膜上皮样恶性间皮瘤鉴别,特别是对于胸腔镜取样的小活检标本和胸水脱落细胞学标本。胸膜上皮样恶性间皮瘤与肺腺癌以及鳞癌鉴别诊断的常用免疫标志物详见表3、4[41]。目前尚无100%的特异性标志物,因此应至少选择2个间皮和2个上皮标志物。根据抗体的敏感度和特异度,间皮瘤最好的标记为钙视网膜蛋白(Calretinin)、CK5或CK5/6、Wilms
肿瘤基因1(Wilms tumour gene 1, WT-1)和D2-40,肺腺癌最特异性的标志物是TTF-1和NapsinA,p63/p40、DSG3是肺鳞癌的特异性标志物,p63和WT-1组合常用于上皮样间皮瘤和鳞癌的鉴别,其中p63在鳞癌中呈弥漫一致的强表达,而在间皮瘤中不表达;WT-1在绝大多数上皮样间皮瘤中表达,而在鳞癌中不表达。其他肺癌标志物,如MOC-31、Ber-EP4、CEA、BG8也常用于鉴别胸膜上皮样间皮瘤。Calretinin在几乎所有的上皮样恶性间皮瘤中呈胞核和质弥漫一致性强表达,但其在约40%的肺鳞癌通常呈局灶性表达,因此对于二者的鉴别诊断作用非常有限。
2.4 肺LCC的诊断和鉴别诊断 按照WHO(2004)肺癌分类,LCC是一类未分化的NSCLC,缺乏小细胞癌、腺癌或鳞癌分化的细胞和结构特征。根据定义,LCC是一类排他性诊断,指的是除外小细胞癌、腺癌和鳞癌之后的排除性诊断。
随着免疫标志物的广泛应用,LCC可根据免疫表型进一步分类。利用抗体组合包括腺癌标志物(如TTF-1、NapsinA、CK7)、鳞癌标志物(如p40、p63、CK5/6、DSG3、CK34βE12)和神经内分泌标志物(如CgA、Syn、CD56)可以将LCC进一步分为4种类型:60%~70%为低分化腺癌,10%~20%为低分化鳞癌,5%为LCNEC、其余为不表达任何标记的未分化癌(非特指类型的LCC)[42-44]。可见大部分LCC实际上是低分化实体性腺癌,但由于黏液染色的敏感度太低(30%),有时该类腺癌可能不能满足WHO(2004)分类和2011年肺腺癌多学科分类对于实体性腺癌的诊断标准,即2个高倍视野中每个视野至少有5个肿瘤细胞经黏液染色(AB-PAS)证实胞质内含黏液。
3 对于NSCLC免疫组化结果的解释
选择有效的抗体(组合)对NSCLC的诊断和鉴别诊断非常重要,但对于免疫组化结果的准确判读同样重要,病理医师在运用这些免疫标志物时,应熟悉每一种抗体的表达谱系,特异度、敏感度以及不同的亚细胞定位。除此之外,还应该牢记光镜下的组织学特征是选择有效的抗体(组合)最重要的前提基础。通常认为,肺鳞癌不表达腺癌标志物(TTF-1、NapsinA),在肺鳞癌中,TTF-1、NapsinA被错误判读为阳性结果可能有如下原因:将陷入癌巢内的反应性Ⅱ型肺泡上皮细胞误认为肿瘤细胞;将丧失TTF-1和NapsinA表达的差
分化实体性腺癌诊断为差分化鳞癌;部分肺鳞癌可能含有少量的腺癌成分致使局灶腺癌分化的区域表达TTF-1;肺泡内的巨噬细胞常表达NapsinA以及抗体的特异度和效价等。
综上所述,肺鳞癌通常不表达TTF-1和NapsinA,但腺癌可不同程度的表达鳞癌标志物(CK5/6、p63),特别是部分差分化实体性腺癌,TTF-1和NapsinA常不表达或呈低表达,对于这部分肿瘤在判断CK5/6和p63表达时应提高警惕,只有当肿瘤细胞呈CK5/6和p63弥漫性强烈(>50%)表达时才能认为是阳性结果。对于TTF-1、NapsinA、CK5/6和p63均不表达的差分化NSCLC,仍不能轻易排除肺腺癌的诊断,可以酌情考虑选择一些特异性稍差的抗体,如CK7呈弥漫一致性强表达,仍应谨慎考虑肺腺癌的诊断。
4 NSCLC个体化治疗的免疫标志物
4.1 EGFR突变的免疫组化检测 美国NCCN指南以及我国专家组共识明确指出,应用EGFR酪氨酸受体阻滞剂
(EGFRTKIs)治疗进展期NSCLC之前应对EGFR突变状态进行检测,以便筛选EGFR TKIs治疗的最适宜对象。EGFR最常见(90%)的突变类型为外显子19的框内缺失突变(del E746-A750)和外显子21的点突变(L858R)。目前免疫组化可用于检测这两种特异性突变类型,其中检测del E746-A750的抗体有两种克隆号,分别为6B6(CST公司)和SP111(Ventana公司);检测L858R的抗体也有两种克隆号,分别为43B2(CST公司)和SP125(Ventana公司)[45-48]。免疫组化染色评分标准通常按照细胞质和(或)细胞膜染色强度以及阳性细胞数量进行:≤10%的肿瘤细胞无或仅呈微弱着色为0分;>10%的肿瘤细胞呈弱着色为1分;肿瘤细胞呈中度着色为2分;肿瘤细胞呈强着色为3分。结果判断标准:0分为阴性,1~3分为阳性。一般认为EGFR突变特异性抗体的特异度较高,但敏感度较差,其中检测L858R的敏感度明显高于del E746-A750,这与外显子19和21存在其他少见突变类型所致的编码蛋白的构象差异有关。6B6和SP111抗体是针对del E746-A750(15bp)设计的,几乎不能检测外显子19的其他缺失类型,如9、12、18和24bp缺失;同样,43B2和SP125抗体是针对L858位点设计的,也不能检测L861Q突变。因此对于免疫组化检测阴性的病例,应警惕假阴性结果以及其他少见突变类型,需应用直接基因测序或PCR的方法进一步检测。免疫组化染色评分与EGFR TKIs疗效:一般认为评分为3分的可直接使用EGFR TKIs治疗,而评分为0~2分需进一步应用分子学方法检测EGFR基因突变。
4.2 ALK融合蛋白的免疫组化检测 ALK融合基因目前已被定义为NSCLC,特别是肺腺癌的一种独特分子亚型。NSCLC患者使用ALK TKIs(克唑替尼,商品名赛可瑞)治疗前应检测ALK融合基因或ALK融合蛋白。应用免疫组化检测ALK融合蛋白表达的抗体主要有D5F3、5A4,其他克隆号如用于检测间变性大细胞淋巴瘤和炎性肌纤维母细胞肿瘤的ALK1和SP-8等,不适合用于检测EML4-ALK融合蛋白[49-51]。免疫组化染色判断为阳性细胞数" 5%的肿瘤细胞呈细胞质染色,根据肿瘤细胞染色强度评分:无细胞染色为0分;微弱胞质染色为1分;中度胞质染色为2分;强胞质颗粒状染色为3分。按照上述判断标准,D5F3和5A4抗体的敏感性和特异性分别为100%和95%~99%,其中免疫组化强阳性染色(3分)与FISH检测结果具有高度一致性(达98%)[52-54]。Ventana ALK融合蛋白免疫组化诊断系统(罗氏公司)已经在欧洲和我国获准用于NSCLC的ALK融合突变检测。该检测系统是在全自动化仪器上操作,使检测流程和结果判读标准化。此外,该检测系统的革新之处在于使用基于非内源性半抗原、信号扩增多聚体和辣根过氧化物酶(HRP)系统的染色信号放大技术。在不影响检测特异性的前提下,使免疫组化检测ALK融合蛋白的敏感性显著提高。Ventana ALK检测系统的结果判断采用更加简便的二分类法,即仅分为阴、阳性两种,与FISH结果的吻合率达98.8%,结果判读的可重复性为99.7%。
其他少见基因突变的免疫标志物有BRAF(V600E)突变特异性单克隆抗体(克隆号VE1)、ROS1融合蛋白特异性单克隆抗体(克隆号D4D6)、RET融合蛋白特异性单克隆抗体(克隆号3F8)。目前,上述免疫标志物应用在NSCLC中的临床资料非常有限,本共识暂不推荐使用。
摘自《临床与实验病理学杂志》2015年31卷5期
我要评论




共0条评论