我的博文
小细胞肺癌转化机制和治疗 
通常认为,肺腺癌和小细胞肺癌是二种不同的疾病,小细胞肺癌来源于位于气道远端的神经内分泌细胞,多数为中央型肺癌,TP53和RB1是高频突变;而肺腺癌起源于肺泡Ⅱ型上皮细胞和 Clara细胞,多数为外周型,常见EGFR或KRAS突变1。然而,非小细胞肺癌和小细胞肺癌共存的病例是真实存在的,而且一些具有EGFR基因突变的肺腺癌在疾病进程中(无论是否经靶向药物治疗)组织学类型会转化为小细胞肺癌1,2,3。
SCLC转化机制
最新研究显示某些小细胞肺癌和非小细胞肺癌属于共同谱系,肺泡II型细胞同时能够引起肺腺癌和小细胞肺癌。见图1,RB1及TP53的失活可能导致II型肺泡上皮细胞向小细胞肺癌发展,导致肺腺癌对靶向药物产生获得性耐药3。
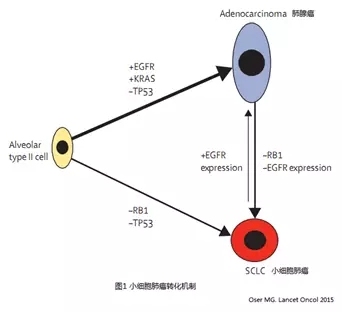
SCLC转化特点
关于肺腺癌向小细胞肺癌转化病例多数为个案报道,美国麻省总医院Sequist等的一项回顾性研究显示,37例EGFR突变肺腺癌经EGFR-TKIs治疗耐药后,有5例(14%)发生小细胞肺癌转化1。
伦敦大学学院癌症研究所的Swanton等认为肺癌等实体瘤存在时空分布异质性,其中肿瘤空间异质性分为四种情况:患者间肿瘤异质性;肿瘤内异质性;转移病灶间肿瘤异质性;转移病灶内异质性4。
发生小细胞肺癌转化的肺腺癌有三个特点:(1)同一肿瘤病灶内存在腺癌和小细胞肺癌成分;(2)不同肿瘤病灶的组织学形态不同;(3)不同时间段的组织学形态不同5。
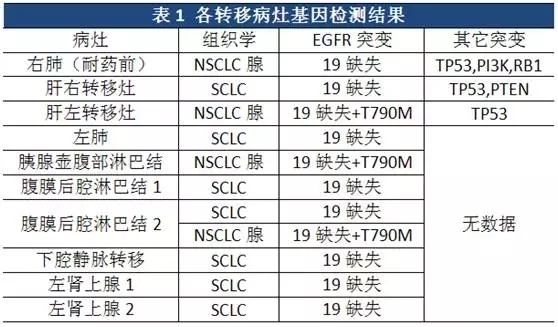
Kenichi Suda等报道了一例76岁的女性肺腺癌患者,无吸烟史,确诊时分期为IIIB,原发右肺。一线同步放化疗15个月后肺部进展,因检测出EGFR 19缺失突变,开始服用易瑞沙。5个月后易瑞沙耐药,全身进展,对颈部淋巴结转移进行放疗后,继续服用易瑞沙3个月后去世。对该患者的10处病灶取样进行了基因检测,结果见表16。
Niederst等对19例EGFR突变肺癌EGFR-TKIs耐药后的肿瘤样本进行了基因分析,其中18例肺腺癌,1例小细胞肺癌,发现9例小细胞肺癌转化,见表27。
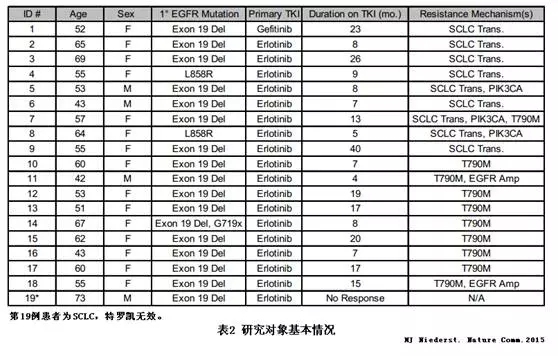
9例小细胞肺癌转化患者,腺癌和小细胞肺癌成分均携带与治疗前相同的EGFR突变,并用免疫组化(IHC)测定抑癌基因RB1的表达情况,均为低表达。体外实验表明RB1失活并不影响易瑞沙的敏感性。从表2中第6例患者的耐药病理组织中分离出EGFR突变的SCLC肿瘤细胞株MGH131-1和MGH131-2,体外实验结果显示,MGH131-1和MGH131-2对易瑞沙和WZ4002耐药,对BCL-2 抑制剂ABT-263 (Navitoclax)敏感(IC50=39nM,110nM)。
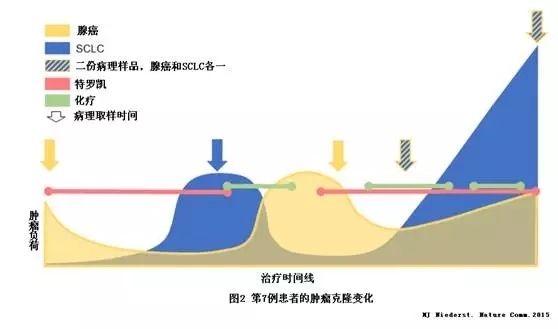
表2中第7例患者的肿瘤克隆变化见图2。
韩国三星医疗中心的Soomin Ahn等检测了401例肺腺癌进展后的病理样本,发现6例(1.5%)发生小细胞肺癌转化,其中2例前后样本均为EGFR阴性,其余4例前后样本均为EGFR阳性。用IHC方法对病理样本检测了TTF-1和CD56,5例CD56阳性(另外1例未检),4例TTF-1阳性8。
与EGFR突变腺癌不同的是,ALK融合阳性腺癌的耐药机制里,小细胞肺癌转化非常罕见。日本神户医疗中心总医院的Shiro Fujita等报道了一例ALK阳性女性腺癌,67岁,不吸烟,骨转和脑转,克唑替尼耐药后,经历了一系列化疗和放疗,开始服用Alectinib,三个月后复查,发现骨转和脑转部分缓解,原发病灶却继续进展。对原发病灶进行了穿刺取样,发现小细胞肺癌转化,ALK、Syn和CD56阳性,TTF-1阴性。而在克唑替尼治疗前的病理组织,ALK和TTF-1阳性,Syn和CD56阴性。该患者接着采用Alectinib联合伊利替康,原发病灶部分缓解,其余病灶继续缩小9。
SCLC转化的监测
SCLC除了隶属于肺癌外,同时也隶属于神经内分泌癌。神经内分泌肿瘤的特异性标记物有:cgA、Syn和CD56,其中CD56是诊断SCLC最敏感且特异性强的神经内分泌标记物10。
TPS、NSE和ProGRP三种肿瘤标志物在SCLC患者血清中都呈现不同程度的高表达,其中NSE的敏感性最强,ProGRP的特异性最强。NSE和ProGRP联合检测时,敏感度和特异性高达92%。
王憨杰等检测了51例SCLC患者一线化疗中的血清TPS、NSE和ProGRP。经过2个周期的标准化疗方案治疗后,总有效率90%。在第1个和第2个周期化疗结束后,与治疗开始前相比,ProGRP和NSE血清浓度出现持续降低;在第2个化疗周期结束后,与第1个化疗周期相结束后相比,二者出现了不同变化:ProGRP浓度仍明显降低,而NSE的降低则无统计学意义。
与ProGRP和NSE相比,SCLC患者的血清TPS表现出了不同的变化规律。在第1个化疗周期结束后,多达41%的患者血清TPS浓度增高,直到第2个化疗周期结束后,才呈现显著降低11。
SCLC转化的治疗
小细胞肺癌对化疗非常敏感。依托泊苷(Etoposide,VP16)或伊利替康(Irinotecan,CPT-11)联合铂类是治疗广泛期SCLC的标准一线方案,二线方案包括紫杉醇、多西他赛、拓扑替康、伊立替康、长春瑞滨、吉西他滨、异环磷酰胺、苯达莫司汀、Nivolumab单药或联合Ipilimumab以及口服依托泊苷,脑转的SCLC也可使用替莫唑胺12。依托泊苷联合铂类同时也是非小细胞肺癌的一线化疗方案13。
对于晚期肺癌患者,必须考虑到副作用和疗效的平衡,相对剂量强度的增加仅带来少许、临床上微不足道的疗效改善。
对于EGFR突变肺腺癌,发生小细胞肺癌转化时,考虑到肿瘤的空间异质性,以及患者的耐受性和依从性,采用EGFR-TKIs联合依托泊苷胶囊可能是比较合理的方案。
依托泊苷胶囊
依托泊苷是细胞周期特异性抗肿瘤药物,作用于S期和G2期,其作用位点是拓扑异构酶Ⅱ。依托泊苷口服0.44小时后吸收,约0.5-3小时后到达血药浓度峰值,平均半衰期为6.8小时。口服生物利用度约为50%14。脑脊液中药物浓度为血中的5%15。
主要不良反应:白细胞和血小板减少,贫血,恶心,呕吐,食欲不振,口腔炎,腹泻,脱发等。白细胞减少最低点发生在7-14天后,血小板减少最低点发生在9-16天后,骨髓毒性无蓄积性。神经毒性和肝肾毒性少见。无心脏毒性和心电图改变14。
每日50-75mg,连续服用三周,停药一周为一个疗程。有研究显示该方案的疗效和副作用优于每日175-200mg,连续服用5天,停药3周的方案,也不弱于依托泊苷静脉注射方案16。也有研究使用每天35mg/m2,连续服用二周,停药一周为一个疗程的方案17。剂量及疗程根据身体状况、病情和症状的严重性适当增减。
转自:https://mp.weixin.qq.com/s?__biz=MzIzODA5NDUzNw==&mid=2648633293&idx=1&sn=fa132260da0fa20e31d152bbda36a75c&chksm=f114de6bc663577d1012a8be9f7559c26489cd5e95e2dd9d8a7d42f8f3072fc981beebf903a2&mpshare=1&scene=1&srcid=02199HDGQLRRLA4lPs6sf8rL&pass_ticket=GKHRxfyGEFNT%2Fu7b1yz3r9oYZRtGDdTj08I%2BgBgqHajqtIleD%2BDqxAiSd4cEaIcn#rd
我要评论




共0条评论