我的博文
T细胞淋巴瘤病理诊断及进展(二)
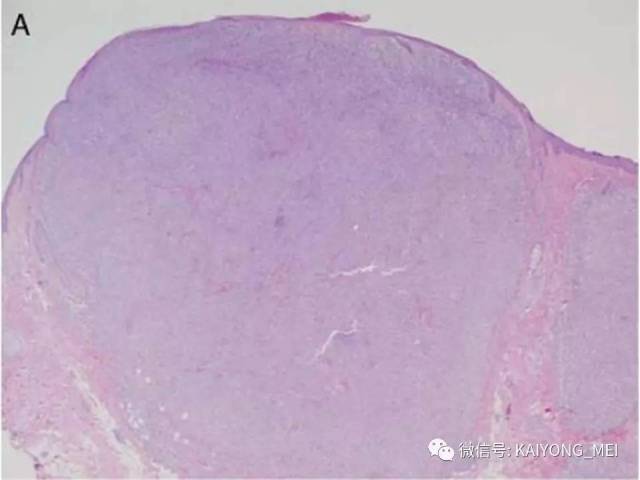
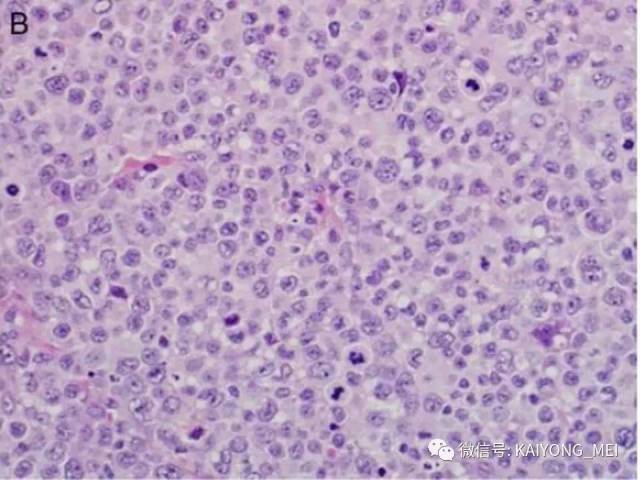
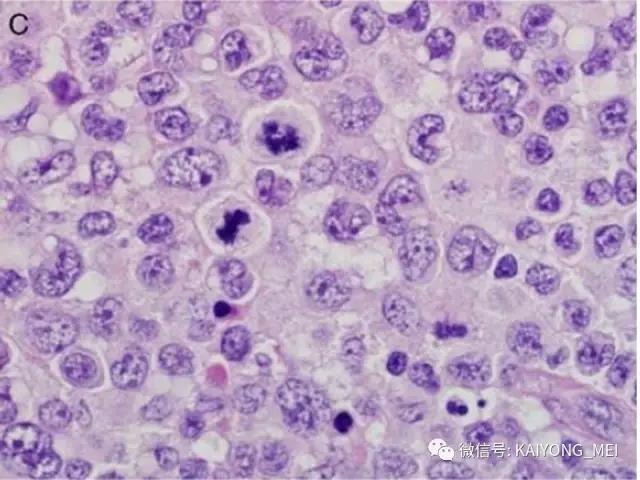
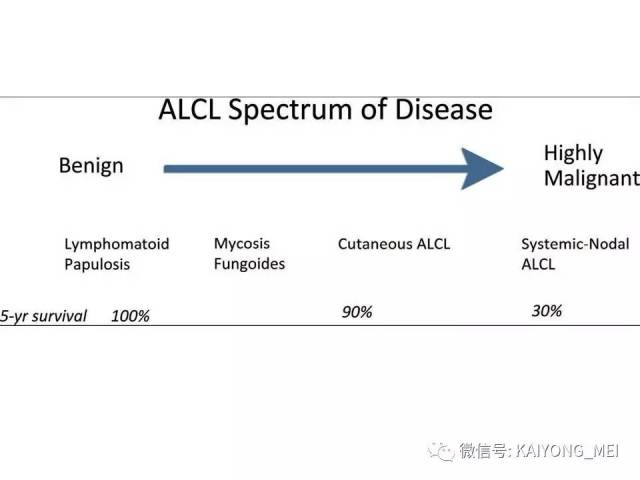
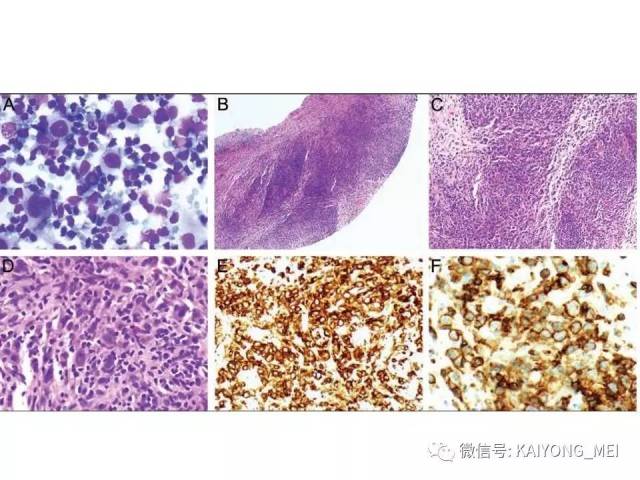
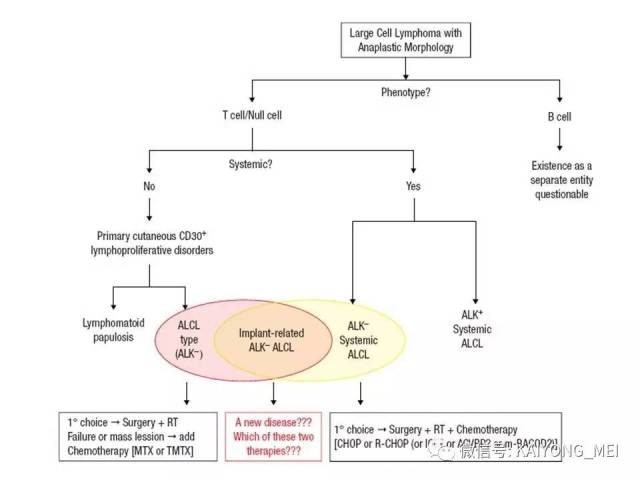
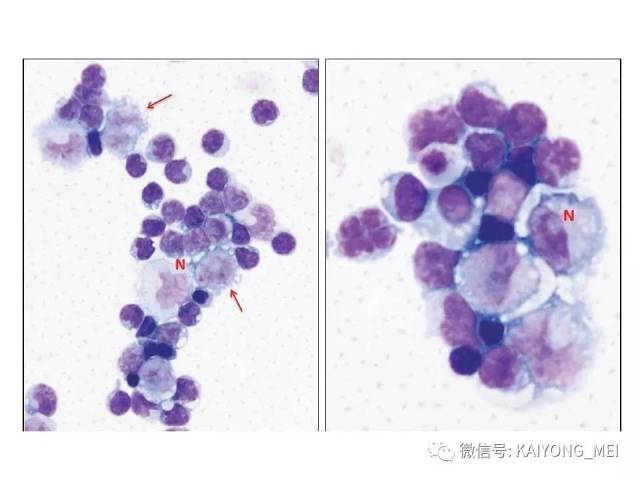
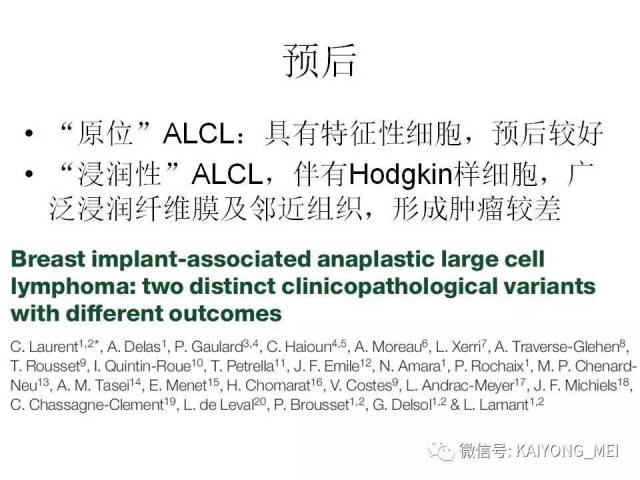
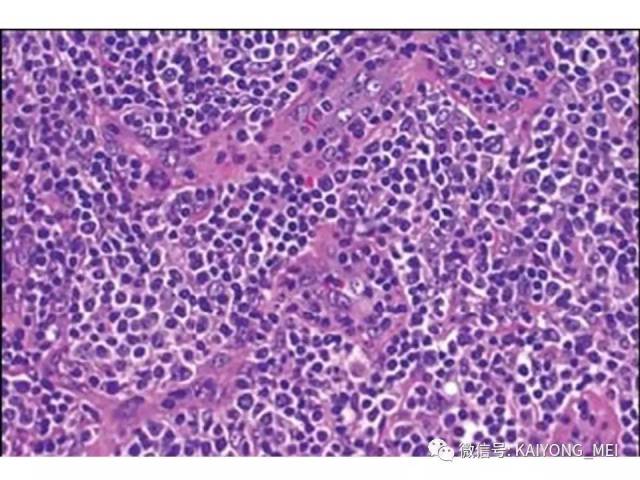
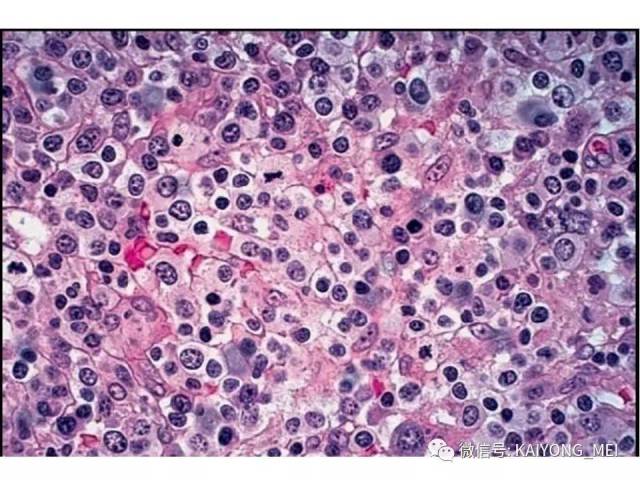
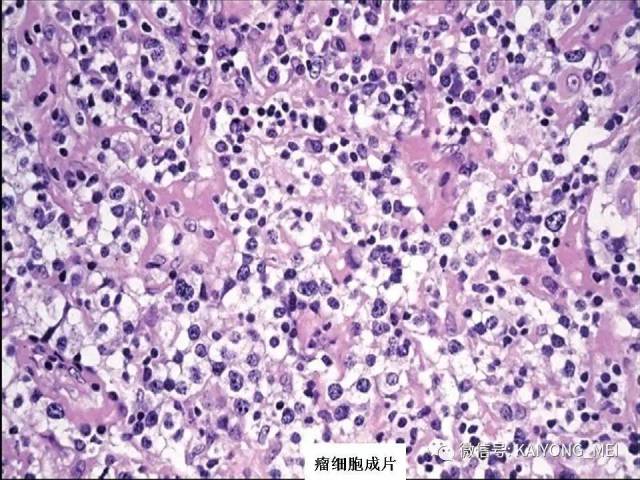
间变性大细胞淋巴瘤(ALCL)通常被认为是一种外周T细胞淋巴瘤(PTCL),具有共同的形态学和免疫表型特征。然而,一些ALCL缺乏T细胞抗原,而这些“祼细胞”肿瘤的起源细胞尚未得到明确证实。ALCL分四种类型:ALK+、ALCL-、原发性皮肤ALCL(pcALCL)和乳腺植入物相关ALCL。尽管具有相似的病理形态学特征,但是这些肿瘤在临床行为和遗传学上有所不同。 ALK+ ALCL和ALK- ALCL是系统性病变, pcALCL发生在皮肤中,虽然可能累及局部淋巴结,但很少全身转移。预后通常非常好。 ALK+ ALCLs一致地具有涉及不同基因伴侣的ALK基因的染色体重排,并且通常具有良好的预后。 ALK-ALCLs缺乏ALK重排,其遗传和临床特征更为多变。 ALK- ALCL的具有DUSP22基因重排时,与ALK+ ALCL预后相似。在部分pcALCL的病例中也存在USP22重排。组织形态学上瘤细胞呈间变,异型性明显,但所有病例均有不同比例的大细胞,一种呈多形性,大小不等,胞质丰富,细胞核大而不规则,呈扭曲、肾形、马蹄形及花环状,甚至见多核及巨核。另一种呈单形性,其特征是体积较大或中等,呈圆形、椭圆或不规则,胞质丰富淡染,核大,染色质呈空泡状,核仁明显。发生于淋巴结者肿瘤常先累及淋巴结副皮质区,然后经淋巴窦播散,常以粘附的方式生长;坏死和纤维化亦常见,并伴有浆细胞、嗜酸性粒和中性粒细胞浸润。
组织学类型:包括经典型、小细胞型、富于淋巴组织细胞型、霍奇金样、肉瘤样型、富于(多核)巨细胞型、富于粘液水肿样间质、富于中性粒细胞/嗜酸性粒细胞、印戒细胞型、腺泡状等组织形态学变异。
ALK+ ALCL是外周T细胞淋巴瘤(至少在大多数情况下)。肿瘤细胞表达来自ALK重排的ALK融合蛋白,并表达CD30。其特征在于通常具有多形核和丰富细胞质的大细胞, 肿瘤细胞被认为是起源于CD4阳性T细胞; 更具体地说,已经提出了与Th17细胞的相似之处,但是它们是否代表真正的肿瘤起源细胞尚不清楚。 主要发生在年轻人中,约占儿童淋巴瘤的20%。 与大多数其他PTCL亚型类似,男性发病率较女性高(男:女=2:1)。ALK+ ALCL主要表现为浅表淋巴结肿大,常伴有B症状。 皮肤,软组织,肝,肺和骨是最常见的结外累及部位,中枢神经系统或胃肠道很少累及。 小细胞型ALCL可表现为白血病样,大约20%的患者有骨髓累及。富于淋巴组织细胞型ALCL常常由于肿瘤细胞稀少,瘤细胞淹没在丰富的淋巴细胞和组织细胞之中,使得这一种亚型非常容易漏诊。
霍奇金样常表现为结节硬化型HL,容易误诊为结节硬化型HL,但后者不表达ALK。肉瘤样型、富于粘液水肿样间质及富于(多核)巨细胞型ALCL形态上容易误诊为未分化肉瘤,对于年轻患者,在诊断未分化肉瘤时先要除外ALCL可能。印戒细胞型及腺泡状ALCL实属罕见形态,对于这种异常罕见形态变异,我们要加强认识,避免误诊和漏诊。
ALK- ALCL最大的进展就是其分子遗传学研究有了新的认识,接近1/3病例伴有DUSP22基因重排,其预后类似ALK+ ALCL,8%的病例伴有TP63基因重排,其预后则不良。其它的改变包括ERBB4的过表达及JAK1/STAT3基因的突变。
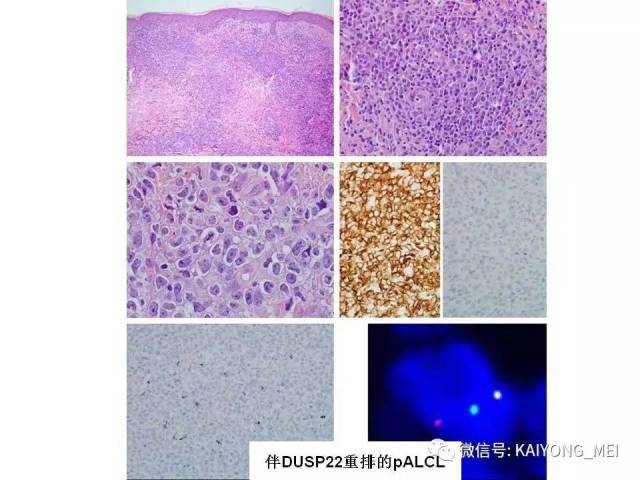
原发皮肤ALCL大部分为局限性病变,少部分为多发性病变。多见于50-70岁老年人,主要累及肢体上半部分,病程持续3-4周,<60岁,孤立性病变者,预后非常好,5年的生存率超过90%,而>60岁,多发性皮肤病变,伴皮肤外病变或累及皮肤以外的其他器官,5年的生存率则仅50%。组织学病变主要累及真皮层,有时可累及皮下脂肪组织,罕见病例可累及表皮,呈paget病样的播散。少数病例可呈血管中心性生长,并浸润血管具有CD8表型及表达细胞毒性分子,需要与皮肤CD8+的侵袭性亲表性细胞毒性T细胞淋巴瘤、NK/T细胞淋巴瘤及γδT细胞淋巴瘤鉴别。近30%的病例存在DUSP22基因重排。
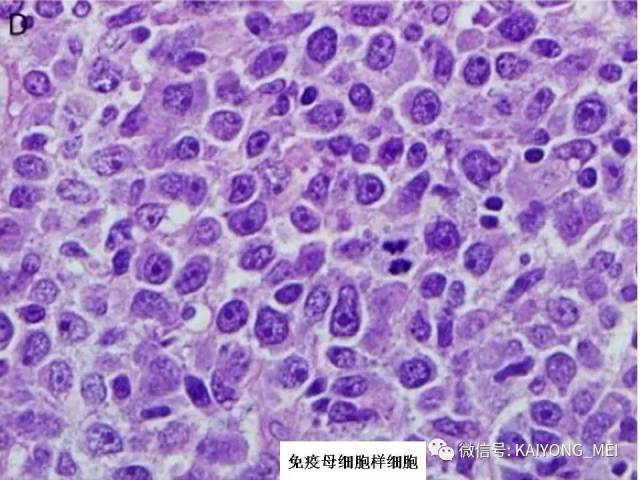
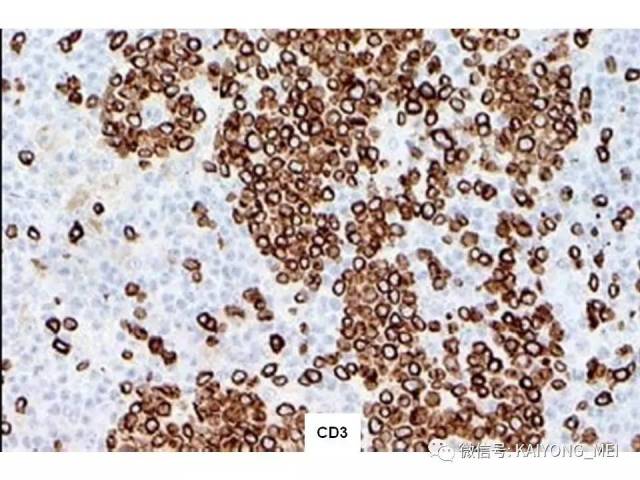
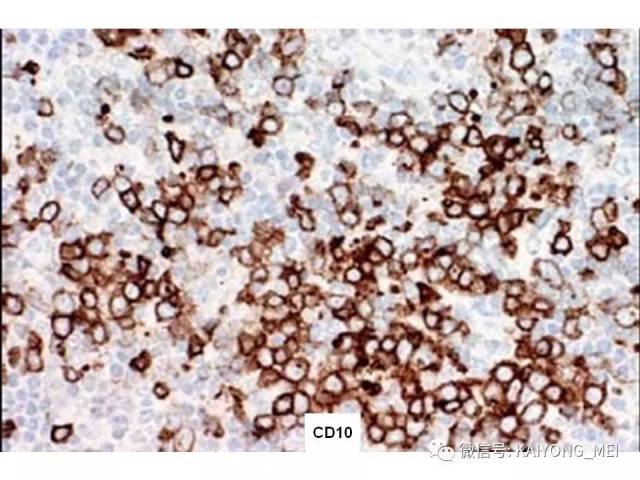
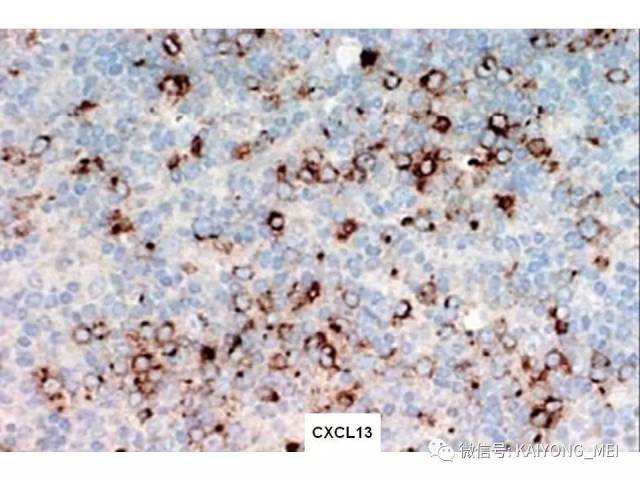
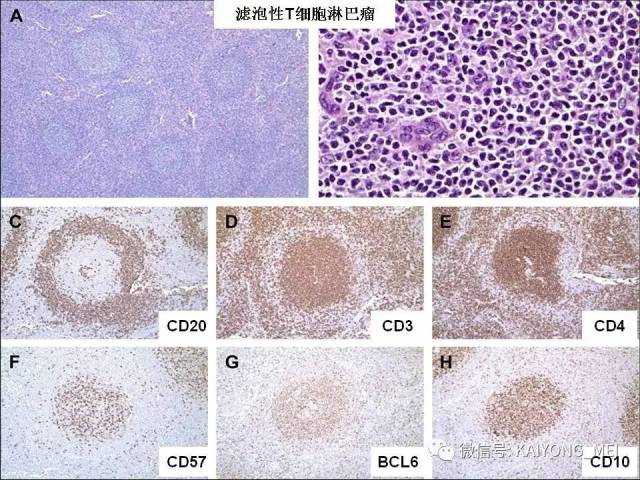
血管免疫母细胞性T细胞淋巴瘤(AITL)是外周T细胞淋巴瘤的一个亚型,具有独特的临床和病理特征。其以T细胞异常增生伴高内皮血管和滤泡树突状细胞(FDC)增生为主要特征。 临床表现为浅表淋巴结肿大、发热、皮疹、肝脾肿大等全身症状,部分病人表现为免疫功能异常和多克隆球蛋白血症等。 近年来许多研究旨在阐明其发病机制和形态,新的治疗策略和预后相关因素相继被提出。与B细胞不同,T细胞的分化及其调控极其复杂。 过去的研究发现,AITL细胞通常携带TFH细胞表型,常表达BCL6、CD10、CXClL13、PD-1、SAP和ICOS,这表明AITL与TFH密切相关。目前研究表明TFH细胞是存在于滤泡中心的CD4阳性+T辅助细胞的一个亚群,为生发中心形成所必需,TFH细胞分化受到CD4+T淋巴细胞与细胞之间相互作用的驱动。 这个交互作用涉及T细胞中ICOS的活化,以及由此导致的磷酸肌醇3激酶(PI3K)通道的活化,从而引起了TFH发育中一个关键调解BCL-6转录因子的表达。在ICOS活化和BCL-6表达的诱发之后细胞上行调节了作为TFH前体的PD1和CXCR5的表达,使得它们迁移到B细胞滤泡去诱发生发中心形成,TFH细胞的刺激和B细胞的抗原递呈最终使得TFH细胞的全面发育。 TFH的恶性转变首先获得TET2和(或)DNMT3A变异RHOAG17V突变和T细胞受体信号通路的活化增强。不受控制的TFH可能诱发细胞因子,如白细胞介素-4(IL-4),白细胞介素白细胞介素-21(IL-21)和白细胞介素-的生成,这些细胞因子在淋巴瘤发展的早期阶段以及形成AITL肿瘤病变背景的大量炎性成分中发挥重要作用。
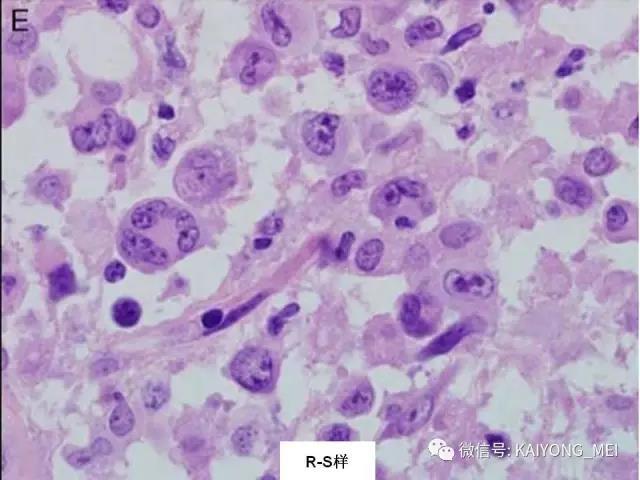
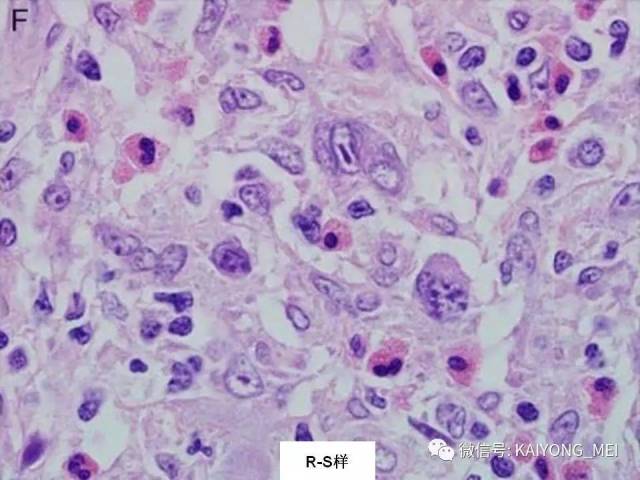
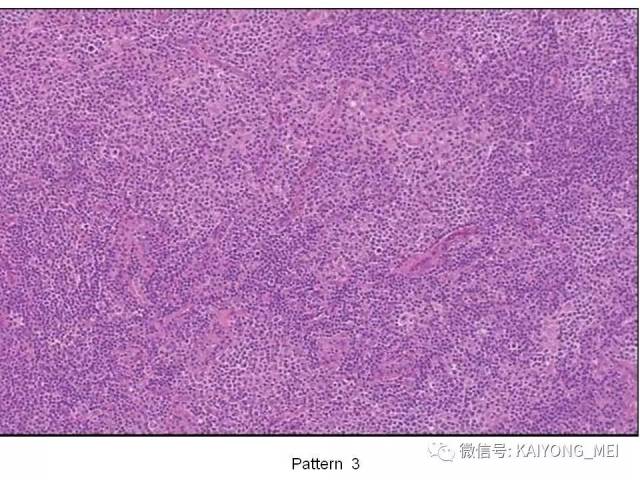
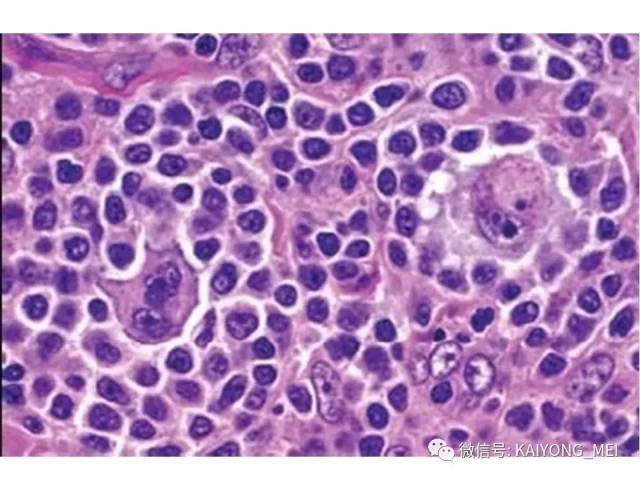
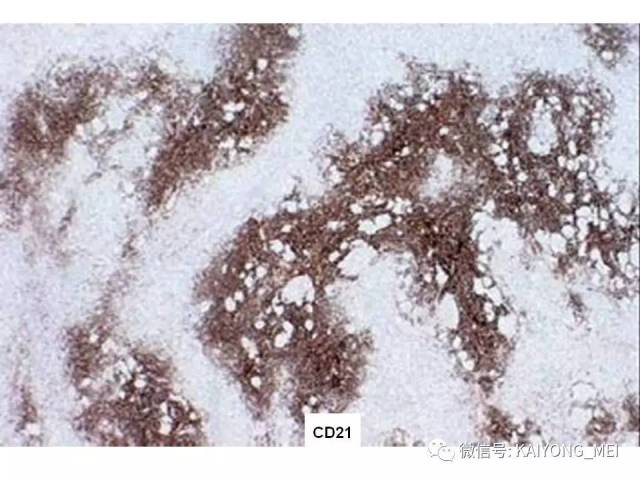
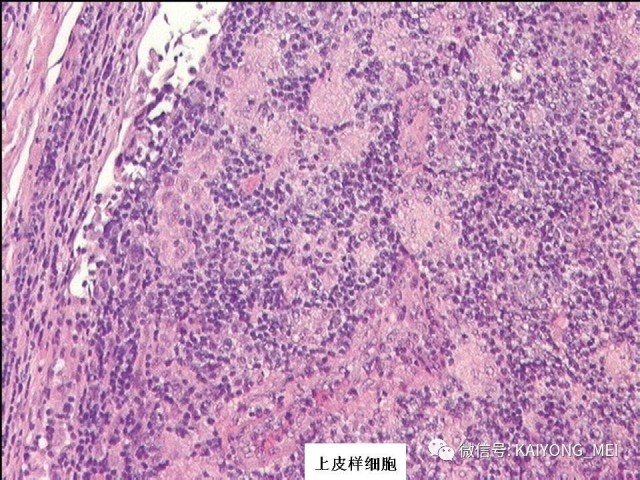
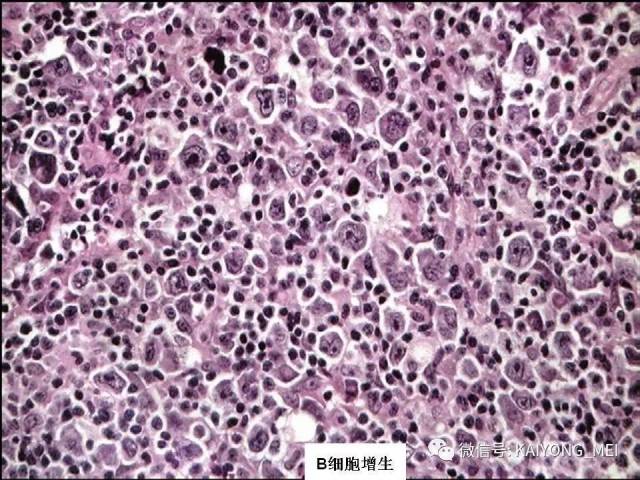
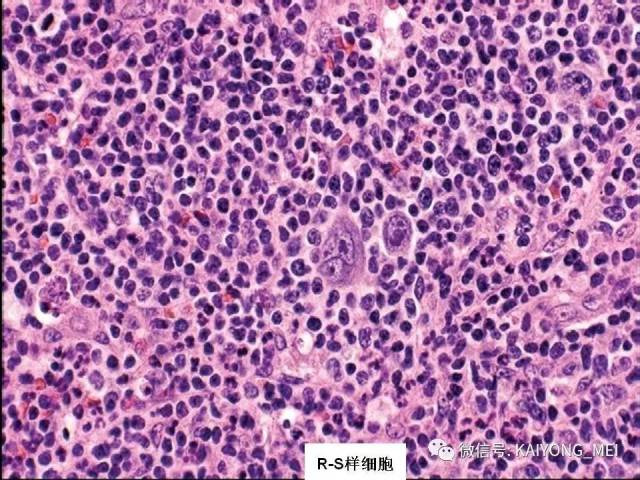
AITL组织学特点:淋巴结构全部或部分破坏,可有残存或萎缩的滤泡,副皮质区呈灶性或弥漫小至中等大小的瘤细胞浸润,瘤细胞胞质淡染或透明,胞核一般呈圆形或椭圆形,染色质细粉尘样,伴有明显的血管增生。 伴复杂背景细胞,包括组织细胞、嗜酸性粒细胞、浆细胞等,常见EBV+的B免疫母细,也可见R-S细胞样B细胞。
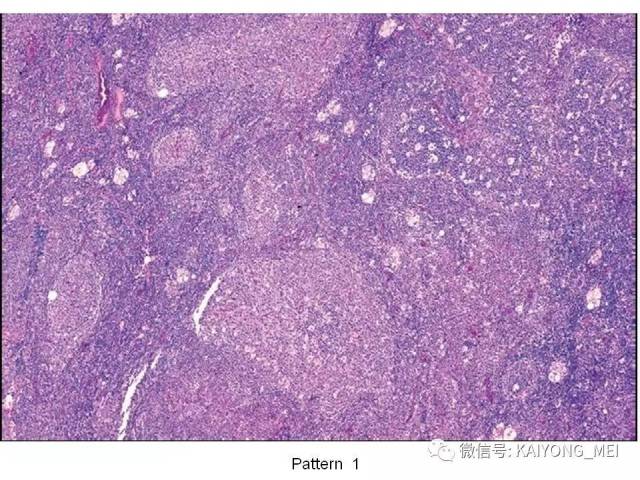
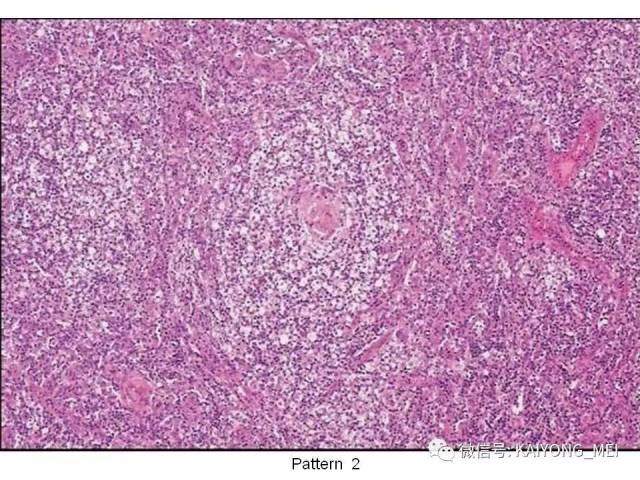
Attygalle根据淋巴结结构破坏程度和残留滤泡的多少将AITL分在3种形态学模式:(1)伴有滤泡增生的AITL,部分淋巴结构破坏,套区缺乏,滤泡增生及副皮质区扩张,其内见多形性细胞浸润;
(2)伴有滤泡减少的AITL,淋巴结大部分被破坏,偶见伴随FDC增生的萎缩滤泡,FDC常可以扩张到滤泡外,副皮质区明显扩张,可见各种背景细胞浸润;
(3)经典型AITL,淋巴结结构完全破坏,FDC明显增生,分枝状高内皮血管增生明显,副皮质区内见各种背景细胞浸润。 前两种组织学模式尤其需要与淋巴结反应性增生相鉴别。 第三种常需要与非特指性外周T细胞淋巴瘤(PTCL-NOS)、经典型霍奇金淋巴瘤、富于T细胞的大B细胞淋巴瘤相鉴别。
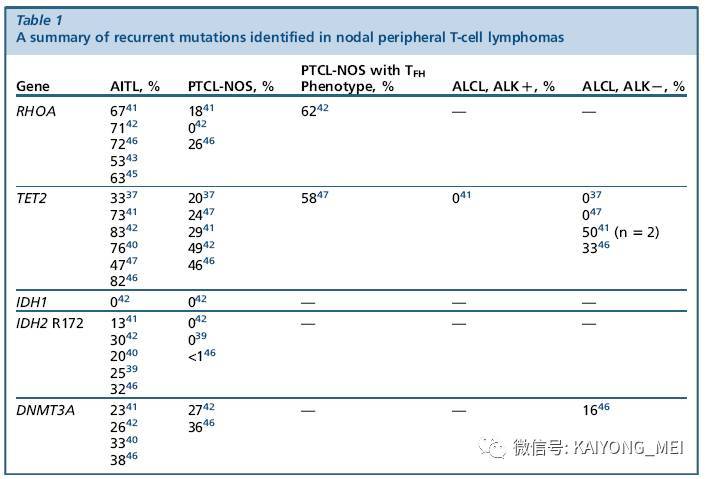
关于AITL的基因遗传学基础一直是研究焦点,现有研究发现AITL病人经常出现TET2,DNMT3A和IDH2突变,但这些突变在AITL中并不具有特异性,PTCL-NOS及骨髓恶性肿瘤中也可以发现。 在AITL中IDH2突变局限于R172 位点。
TET2 的突变率在AITL中近80%。 最近发现,在70%的AITL中有RHOA G17V点突变。 这些突变的发现为AITL靶向治疗提供理论依据。
















我要评论





共0条评论