我的博文
卵巢生殖细胞肿瘤标志物的临床应用
卵巢生殖细胞肿瘤(germ cell tumor,GCT)包括畸胎瘤、无性细胞瘤/精原细胞瘤、卵黄囊瘤、胚胎性癌、非妊娠绒毛膜癌以及混合性生殖细胞肿瘤等。除畸胎瘤之外的恶性GCT可统称为原始GCT。以铂类为基础的新辅助化疗极大改善了GCT患者的预后,但对GCT的准确诊断提出了更高的要求。新型标志物的应用是近年卵巢GCT临床病理学的重要进展之一,它们对卵巢GCT的诊断与鉴别诊断很有帮助。2014版WHO女性生殖器官肿瘤学分类强调了这一点,并对卵巢GCT分类有所调整。
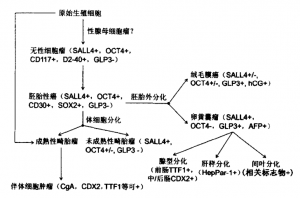
在1946年,Teilum提出了卵巢GCT分类及其组织学发生模式,认为各类卵巢GCT均起源于原始生殖细胞。精原细胞瘤/无性细胞瘤被认为是最原始的GCT,丧失了进一步分化的能力。胚胎性癌被视为一类由多能干细胞构成的肿瘤,可以向体细胞分化成畸胎瘤,也可以向胚胎外组织分化成卵黄囊瘤和绒毛膜癌(图1)。该发生模式目前仍基本沿用,并有一定的临床病理学证据:无性细胞瘤是混合性卵巢GCT最常见的成分,部分病例可向胚胎性癌及其他GCT进一步分化。目前认为,卵巢成熟性囊性畸胎瘤或睾丸青春期前畸胎瘤也可直接起源于原始生殖细胞。近年的工作还发现,未分类小管内生殖细胞肿瘤(intratubular germ cell neoplasia of the unclassified type,IGCNU)是睾丸GCT的浸润前病变,但性腺母细胞瘤是否为卵巢GCT的前驱病变仍有争议。
典型卵巢GCT病例常常依据HE切片即可作出诊断,但在少数情况下,诊断比较困难,例如卵巢GCT与上皮性癌(如卵黄囊瘤与透明细胞癌、子宫内膜样腺癌)、GCT各亚型之间(如实体型、乳头型卵黄囊瘤与胚胎性癌,卵黄囊瘤与无性细胞瘤假腺样-小管状变异型、间变型精原细胞瘤与胚胎性癌等)的鉴别诊断。免疫组织化学染色对各类卵巢GCT的诊断与鉴别诊断很有价值(表1)。但是,任何卵巢GCT标志物均有一定局限性。因此,免疫组织化学染色的结果解释必须以病理组织学改变为前提。
除精原(无性)细胞瘤外,GCT均可表达相对低分子质量细胞角蛋白(CK)和广谱CK(AE1/AE3),但一般不表达EMA和CK7(畸胎瘤可表达)。SALL4、胎盘碱性磷酸酶(PLAP)在大多数GCT均有表达,可视为GCT的广谱标志物。PLAP为细胞质和细胞膜着色,常为局部阳性,染色强度偏弱。它在浆液性癌也有表达。SALL4为细胞核着色,精原(无性)细胞瘤、卵黄囊瘤、胚胎性癌以及未成熟性畸胎瘤等恶性GCT中100%表达。除未成熟性畸胎瘤外,其他GCT均强阳性表达SALL4。非妊娠绒毛膜癌表达弱或不表达SALL4。在非生殖细胞肿瘤中,仅7%的透明细胞癌局灶、弱表达SALL4。其他常见肿瘤如浆液性癌、卵巢颗粒细胞瘤等不表达SALL4。因此,SALL4是一个特异、敏感的GCT标志物,可列为首选。SALI4、EMA和CK7的联合应用,可以很好地鉴别原始GCT和低分化癌。
OCT4(POU5F1)在无性细胞瘤/精原细胞瘤和胚胎性癌中呈弥漫细胞核阳性,但在化疗后病例中常常阴性。卵黄囊瘤、成熟性畸胎瘤、类癌等OCT4阴性,仅少数卵巢上皮性癌局灶阳性。无性细胞瘤常用标志物还包括CD117和D2-40。CD117为弥漫细胞膜阳性,仅1/3病例蛋白表达与基因突变有关。约半数实体型卵黄囊瘤及少数高级别浆液性癌可表达CD117。D2-40表达的特异性相对较差,颗粒细胞瘤、绒毛膜癌、成熟性畸胎瘤、间皮来源的肿瘤、浆液性癌和子宫内膜样腺癌等均有不同程度的D2-40表达。甲胎蛋白在卵黄囊瘤阳性率约60%,多呈局部片块样表达模式。在实体型卵黄囊瘤甲胎蛋白表达率不足40%。GLP3(glypican-3)在卵黄囊瘤的表达率约97%,近90%病例表达较强(>10%)。绒毛膜癌也表达GLP3,但它通常不易与卵黄囊瘤混淆。因此,GLP3是一个比甲胎蛋白理想的卵黄囊瘤标志物,联合OCT4,可用于和其他原始GCT的鉴别诊断,特别是实体型或乳头型卵黄囊瘤和胚胎性癌的鉴别诊断,以及在混合性生殖细胞肿瘤中确定卵黄囊瘤成分。但是,在转移性肝细胞肝癌、肝样腺癌、伴有肝细胞分化的性索间质肿瘤及约1/3的透明细胞癌中,GLP3有不同程度的表达。因此,它不是一个卵黄囊瘤特异性标志物。胚胎性癌可表达CD30和SOX2 [SRY (sex determining region Y)-box 2],但两者敏感性均不高,宜与OCT4、SALI4以及其他GCT标志物联合应用。各类GCT的主要免疫表型归纳于图1。
图1 卵巢生殖细胞肿瘤的组织学起源与主要免疫表型
表1 卵巢恶性生殖细胞肿瘤的常用标志物表达结果
摘自 中华病理学杂志2015年44卷12期 作者: 吕炳建 程亮
我要评论









共0条评论